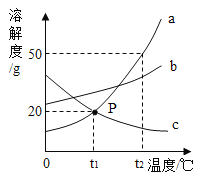
题目内容
【题目】某同学制作的试剂标签如下,其中化学式书写不正确的是
A. B.
B.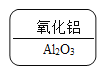 C.
C.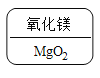 D.
D.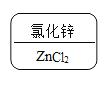
【答案】C
【解析】
本题主要考查方程式的书写,利用化合价书写化学方程式。另外书写的物质还要与标签名称相对应。
A. 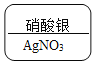 银是+1价,硝酸根是-1价,根据代数和为0和化学式的书写规则,硝酸银的化学式为AgNO3。故A不符合题意;
银是+1价,硝酸根是-1价,根据代数和为0和化学式的书写规则,硝酸银的化学式为AgNO3。故A不符合题意;
B. 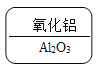 铝是+3价,氧是-2价,根据代数和为0和最小公倍数的书写规则,氧化铝的化学式为:Al2O3。故B不符合题意;
铝是+3价,氧是-2价,根据代数和为0和最小公倍数的书写规则,氧化铝的化学式为:Al2O3。故B不符合题意;
C. 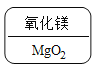 镁是+2价,氧显-2价,根据代数和为0和最小公倍数的书写规则,氧化镁的化学式应为MgO。故C符合题意;
镁是+2价,氧显-2价,根据代数和为0和最小公倍数的书写规则,氧化镁的化学式应为MgO。故C符合题意;
D. 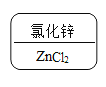 锌是+2价,氯显-1价,根据代数和为0和最小公倍数的书写规则,Cl氯化锌的化学式为ZnCl2。故D不符合题意。
锌是+2价,氯显-1价,根据代数和为0和最小公倍数的书写规则,Cl氯化锌的化学式为ZnCl2。故D不符合题意。
故选C。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
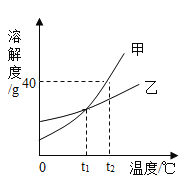
激活思维智能训练课时导学练系列答案【题目】通过学习,我们已经了解了常见金属在溶液中的活动性顺序。铬(Cr)是重要的金属材料,越来越受到人们的关注。某化学兴趣小组对Cr、Al、Cu的金属活动性顺序进行探究,过程如下:
(提出假设)
(1)对三种金属的活动性顺序提出三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.________________
(查阅资料)该研究小组必须查阅的资料是_________(填序号)
①Cr、Al、Cu三种金属的密度②Cr能否与酸反应③Cr、Al、Cu三种金属导电性
(设计实验)
同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,观察现象,记录如表:
金属 | Cr | Al | Cu |
与盐酸反应现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
(控制实验条件)
(2)打磨三种金属的目的____________;上述实验使用等浓度的盐酸溶液的理由是___________________。
(得出结论)
(3)原假设中正确的是_______(填假设中“a”“b”或“c”).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式:___________。
(结论应用)
(4)根据探究结果,写出Al丝与CuSO4溶液反应的化学方程式_______________,并写出反应的实验现象___________________。
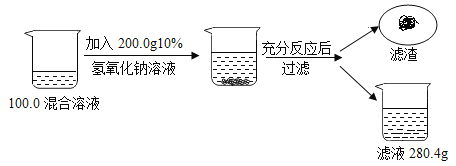
【题目】自制汽水。在500 mL的饮料瓶中加入2勺白糖、1.5 g小苏打,注入凉开水,再加入1.5 g柠檬酸(C6H8O7),立即旋紧瓶盖,摇匀。
(资料)反应原理:3NaHCO3 + C6H8O7=C6H5O7Na3 + 3H2O+ 3CO2↑
请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
(1)柠檬酸中碳、氢元素的质量比为_____。 (2)制得的汽水呈酸甜口味,依据数据阐述呈酸味的理由是_____。 | (1)柠檬酸中碳元素的质量分数为37.5%,其计算式为_____。 (2)加入柠檬酸后,立即旋紧瓶盖的原因是_____。 |
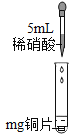
【题目】同学们通过学习知道铜与盐酸、稀硫酸不能发生反应,但却发现化学老师用铜与浓硝酸制备出了NO2气体去做物理实验。同学们对此很感兴趣,在实验室对铜与硝酸的反应进行了探究。
实验I | 实验II | ||
实验装置 | 实验现象 | 实验装置 | 实验现象 |
| 铜片逐渐消失, 有无色气泡产生,试管中上部有红棕色气体出现;溶液由无色变为蓝色 |
| 铜片逐渐消失, 产生红棕色气体,溶液由无色变为绿色 |
(探究一)实验I中产生的无色气体是什么?
(查阅资料)
(1)硝酸(HNO3)与Cu反应生成硝酸铜和含氮元素的化合物;硝酸铜溶液呈蓝色
(2)含氮元素的某些气态物质的物理性质
NH3 | NO | NO2 | |
颜色 | 无色 | 无色 | 红棕色 |
气味 | 刺激性 | 刺激性 | |
溶解性 | 极易溶于水 | 难溶于水 | 可溶于水或硝酸 |
(3)NO2与水反应生成无色的硝酸和NO气体
(猜想与假设)无色气体可能是:①NH3 ②NO
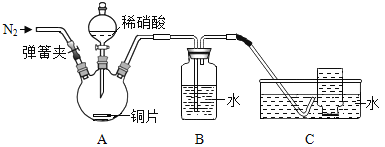
(进行实验)同学们利用下图装置对产生的无色气体进行检验。
实验操作 | 实验现象 |
1. 打开弹簧夹,通入N2,一段时间后,关闭弹簧夹 | B、C中导管口有无色气泡冒出 |
2. 将C中导管伸入集气瓶中,打开分液漏斗的活塞,滴入一定量稀硝酸,关闭活塞 | A中有无色气泡产生 B中导管口有无色气泡冒出 C中集气瓶内收集到无色气体 |
3. 从水槽中取出集气瓶,敞口置于空气中 | 无色气体变为红棕色 |
4. 取少量B中液体于试管中,滴加无色酚酞溶液 | 试管中溶液颜色无明显变化 |
(解释与结论)
(1)操作1中,通入N2的目的是_____。
(2)同学们认为猜想①不正确,理由是_____。
(3)无色气体具有的化学性质是_____。
(探究二)为什么实验II中的溶液呈绿色而不是蓝色?
(猜想与假设)①溶液中硝酸铜的质量分数较高②硝酸铜溶液中溶解了生成的气体
(设计实验)同学们设计了以下4个实验方案。
方案1 | 配制饱和硝酸铜溶液并稀释至不同的浓度,观察溶液颜色变化 |
方案2 | 加水稀释实验II所得的绿色溶液,观察溶液颜色变化 |
方案3 | 取实验II所得的绿色溶液,加热,观察溶液颜色变化 |
方案4 | 配制饱和硝酸铜溶液,…… |
(反思与评价)
(1)“方案1”和“方案3”中,能验证猜想②的是_____。
(2)“方案2”不能验证猜想①的原因是_____。
(3)“方案4”也可验证猜想②,该方案是:配制饱和硝酸铜溶液,_____。
(4)通过实验I、II与已有知识的对比,可得出的结论是_____(答一条即可)。
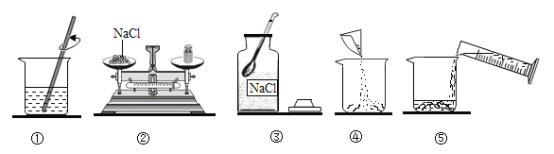
【题目】化学兴趣小组的同学在探究碱溶液的化学性质时,进行了下图所示的实验。
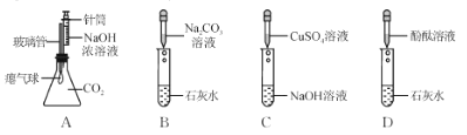
(1)实验 A 中,推入 NaOH溶液后,可观察到的现象是____。
(2)实验B 中发生反应的化学方程式为______。
实验结束后,小组同学对B 试管中上层清液的溶质成分产生疑问,作出猜想:
猜想一:只含有 NaOH;猜想二:含有 NaOH、Na2CO3;猜想三:含有 NaOH、Ca(OH)2。同学们取少量B 试管中的清液分别置于甲、乙两支试管中,进行探究:
实验操作 | 实验现象 | 结论 |
在试管甲中滴加碳酸钠溶液 | 不产生白色沉淀 | 猜想三错误 |
在试管乙中滴加足量稀盐酸 | ______ | 猜想二正确 |
(3)A、B、C、D 四个实验中能体现碱化学通性的是 ____(填字母)。小组同学经过 讨论认为 A、B、C、D 四个实验并没有探究出碱所有的化学通性。从这四个实验中选择一个,继续加入相关试剂,能得出碱的其它化学通性。实验的方案是___________(写出操作和现象)。