题目内容
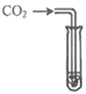
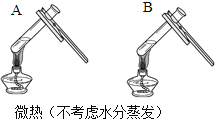
【题目】为探究碳还原氧化铜的最佳实验条件,取木炭粉和氧化铜的干燥混合物1-2.5g用如图所示装置进行实验。
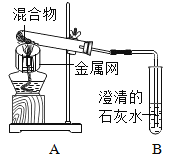
(1)木炭还原氧化铜的化学方程式为__。实验过程中A装置中试管内产生的现象是__。
(2)酒精灯火焰加金属网罩的目的是____。
(查阅资料)①氧化铜(CuO)为黑色固体。②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+H2O+Cu
(进行试验)取一定量的混合物,用上图所示装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2 | 1:10 | 混有很少量黑色物质 | |
3 | 1:11 | 混有极少量黑色物质 | |
4 | 1:12 | 无黑色物质 | |
5 | 1:13 | 混有较多黑色物质 | |
(结论与解释)(3)由上述实验可以得到的结论是___,条件最佳。
(反思与评价)
(4)为了检验生成的红色固体中是否含有Cu2O,所需试剂是____。
(5)该装置与教材中的装置相比略作改进,实验结束时,可先用弹簧夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止____。
【答案】2CuO+C![]() 2Cu+CO2↑ 黑色粉末变成红色 使火焰集中,提高温度 木炭粉与氧化铜的质量比为1:12时 稀硫酸(或稀盐酸) 空气进入试管与热的铜反应使铜再次被氧化
2Cu+CO2↑ 黑色粉末变成红色 使火焰集中,提高温度 木炭粉与氧化铜的质量比为1:12时 稀硫酸(或稀盐酸) 空气进入试管与热的铜反应使铜再次被氧化
【解析】
(1) 木炭粉和氧化铜在高温条件下反应生成铜和二氧化碳,反应的化学方程式为2CuO+C![]() 2Cu+CO2↑;所以实验过程中A装置中试管内产生的现象是黑色粉末变成红色;
2Cu+CO2↑;所以实验过程中A装置中试管内产生的现象是黑色粉末变成红色;
(2) 酒精灯的火焰上加有金属网罩可使火焰集中加热提高火焰的温度;
(3) 由实验提供的数据以及实验现象可以看出,木炭与氧化铜质量比为1:12时恰好完全反应,因此木炭与氧化铜反应的最佳质量比为1:12;
(4) 为检验生成的红色固体中是否含Cu2O,根据题干提供的信息,氧化亚铜能与硫酸反应生成蓝色的额硫酸铜反应,故所需试剂是稀硫酸;
(5) 铜和氧气在加热的条件下生成氧化铜,所以除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止铜被重新氧化。

【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
【查阅资料】CaC12 滚液显中性
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12 猜想II:有__________
猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。
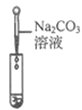
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。
【题目】根据图示回答相关问题。
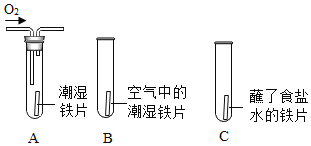
(1)下列通过对照实验探究影响铁生锈的因素。
实验 | 分析 |
| 一段时间后发现A、C 中铁片变红,B中铁片依然光亮,对比A、B中的现象,说明决定铁生锈快慢的一个重要因素是___________;对比B、C中的现象,说明铁生锈快慢与____________有关。 |
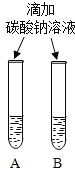
(2)小明同学设计如下两种方案鉴别氢氧化钠和氢氧化钙两种饱和溶液。
实验一 | 实验二 | 分析 |
|
| 两种方案中均观察到B试管内出现白色浑浊,则B中溶液为______(填名称) ;实验二的设计原理是_____________。 |
【题目】通过学习,我们已经了解了常见金属在溶液中的活动性顺序。铬(Cr)是重要的金属材料,越来越受到人们的关注。某化学兴趣小组对Cr、Al、Cu的金属活动性顺序进行探究,过程如下:
(提出假设)
(1)对三种金属的活动性顺序提出三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.________________
(查阅资料)该研究小组必须查阅的资料是_________(填序号)
①Cr、Al、Cu三种金属的密度②Cr能否与酸反应③Cr、Al、Cu三种金属导电性
(设计实验)
同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,观察现象,记录如表:
金属 | Cr | Al | Cu |
与盐酸反应现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
(控制实验条件)
(2)打磨三种金属的目的____________;上述实验使用等浓度的盐酸溶液的理由是___________________。
(得出结论)
(3)原假设中正确的是_______(填假设中“a”“b”或“c”).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式:___________。
(结论应用)
(4)根据探究结果,写出Al丝与CuSO4溶液反应的化学方程式_______________,并写出反应的实验现象___________________。