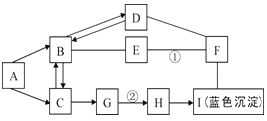
题目内容
【题目】水和溶液在生命活动和生产、生活中起着十分重要的作用。请回答下列问题:
① 在水的净化过程中,常利用 (11) (填物质名称)的吸附性除去水中异味。净化过的水通入氯气后输送到每家每户,其中通入氯气的作用是 (12) 。
② 下表是NaOH和Ca(OH)2的溶解度数据(单位:g/100g水),请回答下列问题。
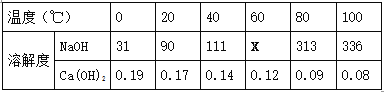
Ⅰ.表示溶解度的符号是 (13) ;表中“111”数字表示的含义是 (14) 。
Ⅱ.为测定X的值,取4份60℃的水各50克,分别进行实验,并记录数据如下表:
实验编号 | 实验1 | 实验2 | 实验3 | 实验4 |
NaOH质量/g | 50 | 60 | 70 | 80 |
H2O质量/g | 50 | 50 | 50 | 50 |
溶液质量/g | 100 | 110 | 114.5 | 114.5 |
【实验结果分析】实验1所得溶液的质量分数为 (15) ;由实验可知X的值为 (16) 。
Ⅲ.除去NaOH溶液中混有的少量Ca(OH)2,通过蒸发浓缩、 (17) ,然后过滤、洗涤、干燥得到NaOH固体。
Ⅳ.现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后,恢复到原来温度得到的溶液(乙溶液),甲、乙溶液中溶质质量甲 (18) 乙(填“>、<、=”)。
Ⅴ.在20℃时,向盛有100g水的烧杯中加入111gNaOH,欲使其完全溶解变成不饱和溶液。下列说法中正确的是 (19) 。
A.溶液的质量可能不变 B.溶质的质量分数一定减小
C.溶液中溶质的质量一定增大 D.可以升温到40℃以上
E.NaOH的溶解度一定变大 F.20℃时加入的水的质量>23.4g
【答案】①活性炭(木炭) 消毒杀菌 ②Ⅰ、S 40℃时,氢氧化钠的溶解度为111g/100g水 Ⅱ、50% 129 Ⅲ、降温结晶 Ⅳ、> Ⅴ、C、D、F
【解析】
试题分析:①活性炭(木炭)具有吸附性,故在水的净化过程中,常利用活性炭(木炭)的吸附性除去水中异味;净化过的水通入氯气后输送到每家每户,其中通入氯气的作用是消毒杀菌
②Ⅰ、表示溶解度的符号是S;溶解度的概念理解:表示在一定温度下,在100g水中达到饱和状态所溶解的溶质质量,故表中“111”数字表示的含义是:40℃时,氢氧化钠的溶解度为111g/100g水
Ⅱ、根据溶质质量分数计算的表达式,实验1所得溶液的质量分数=50g/100g×100%=50%;通过表中数据可知,在50g水中最多只能溶解NaOH的质量=114.5g-50g=64.5g,故在100g水中最多只能溶解NaOH的质量=64.5g×2=129,所以X=129
Ⅲ、根据溶解度随温度的变化趋势可知,NaOH的溶解度随温度的升高变化较大,故要使氢氧化钠从溶液中析出,宜采用降温结晶
Ⅳ、由于CaO会与水反应生成氢氧化钙,等于将饱和溶液蒸发了水分,溶质结晶析出,故甲溶液中溶质质量甲>乙溶液中溶质质量甲
Ⅴ、根据NaOH的溶解度,在20℃时,向盛有100g水的烧杯中加入111gNaOH,为饱和溶液,故由氢氧化钠饱和溶液变为不饱和溶液的方法:加溶剂、升高温度,A、故溶液的质量一定增大不变,错误,B、当采用升高温度的方法,此时溶液的溶质质量分数增大,故错误,C、因为一定要将未溶解的NaOH溶解,故溶液中溶质的质量一定增大,正确,D、根据NaOH的溶解度,在20℃时,NaOH的溶解度为111g,故可以升温到40℃以上,正确,E、当采用加水的方法,NaOH的溶解度不变,错误,F、在20℃时,NaOH的溶解度为90g,故还有未溶解的NaOH质量=111g-90g=21g,故需要溶解21gNaOH需要的水质量=21g×100g÷90=23.3g,故20℃时加入的水的质量>23.4g,正确,故选C、D、F

 教材全解字词句篇系列答案
教材全解字词句篇系列答案