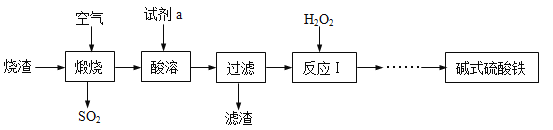
题目内容
【题目】根据下列实验装置示意图,请回答下列问题:
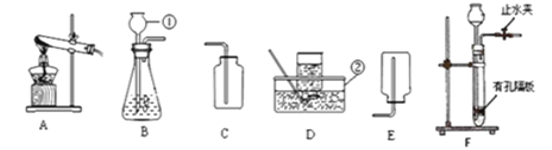
写出标号①的仪器名称:① ;
(2)实验室用氯酸钾和二氧化锰的混合物制取O2的化学方程式为 ;收集 O2的装置可选择 (填字母)。完全反应后的固体残渣,通过以下四步实验操作可回收得到较纯净的二氧化锰(残渣中只有二氧化锰难于水).正确操作的先后顺序是 (填写选项符号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(3)在实验室用大理石和稀盐酸制取CO2的实验装置中,F装置相对于B装置具有的优点是 ;并写出该反应的化学方程式 ;
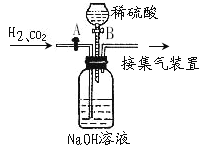
 (4)工业常需分离H2、CO2的混合气体,某同学采用如下图所示的装置也能达到分离该混合气体的目的。操作步骤如下:① (填操作),通入混合气体,可收集到_____气体。②然后________________(填操作),又可收集到另一种气体,写出产生另一种气体的化学方程式 。
(4)工业常需分离H2、CO2的混合气体,某同学采用如下图所示的装置也能达到分离该混合气体的目的。操作步骤如下:① (填操作),通入混合气体,可收集到_____气体。②然后________________(填操作),又可收集到另一种气体,写出产生另一种气体的化学方程式 。
【答案】⑴ 长颈漏斗 ⑵2KClO3 ![]() 2KCl+3O2↑;C或D;bcda⑶ 可以控制反应的发生和停止;略;
2KCl+3O2↑;C或D;bcda⑶ 可以控制反应的发生和停止;略;
⑷ 关闭活塞B,打开活塞A H2; 关闭活塞A,打开活塞B; Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
【解析】
试题分析:(2) 氯酸钾和二氧化锰的混合物产生氯化钾和氧气,方程式为2KClO3 ![]() 2KCl+3O2↑,氧气的密度大于空气,且不易溶于水,可以用排水法和向上排空气法即C或D;二氧化锰在反应中作为催化剂,正确操作的先后顺序是bcda;(3)实验室制CO2是用块状石灰石和稀盐酸在常温产生方程式为CaCO3+2HCl==CaCl2+H2O+CO2↑;F装置相对于B装置具有的优点是可以控制反应的发生和停止;(4)NaOH溶液能与CO2反应,H2不能,故关闭活塞B,打开活塞A,可以收集H2;然后关闭活塞A,打开活塞B,稀盐酸与CO2与NaOH反应产生的Na2CO3反应产生CO2,方程式为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
2KCl+3O2↑,氧气的密度大于空气,且不易溶于水,可以用排水法和向上排空气法即C或D;二氧化锰在反应中作为催化剂,正确操作的先后顺序是bcda;(3)实验室制CO2是用块状石灰石和稀盐酸在常温产生方程式为CaCO3+2HCl==CaCl2+H2O+CO2↑;F装置相对于B装置具有的优点是可以控制反应的发生和停止;(4)NaOH溶液能与CO2反应,H2不能,故关闭活塞B,打开活塞A,可以收集H2;然后关闭活塞A,打开活塞B,稀盐酸与CO2与NaOH反应产生的Na2CO3反应产生CO2,方程式为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O

【题目】研究学习小组选择“活性炭的吸附效果和哪些因素有关”的课题进行研究,以下是他们探究的过程:
提出假设:活性炭的吸附效果和活性炭的量有关
完成实验:按下表进行实验,取容积相同的集气瓶(125ml),收集满红棕色的二氧化氮气体,并进行编号,记录颜色消失的时间。
实验编号 | 活性炭纯度 | 活性炭的用量(克) | 消失时间(秒) |
1 | 80% | 1.0 | 60 |
2 | 9.0 | 45 |
分析数据,得出结论
要完成本实验,实验标号2中活性炭的纯度应该为
(1)该探究过程得出的结论是:
反思:
某品牌冰箱的除味剂主要成分是活性炭,其说明书中写到“切勿靠近高温”,原因是活性炭具
有: 写出能反映该性质的化学方程式:
(3)活性炭的吸附效果还和那些因素有关?请你帮他们继续探究(只要求提出假设和实验方案)。
假设:
实验方案:
(4)人们利用活性炭的吸附性还可以
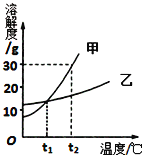
【题目】水和溶液在生命活动和生产、生活中起着十分重要的作用。请回答下列问题:
① 在水的净化过程中,常利用 (11) (填物质名称)的吸附性除去水中异味。净化过的水通入氯气后输送到每家每户,其中通入氯气的作用是 (12) 。
② 下表是NaOH和Ca(OH)2的溶解度数据(单位:g/100g水),请回答下列问题。
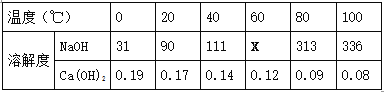
Ⅰ.表示溶解度的符号是 (13) ;表中“111”数字表示的含义是 (14) 。
Ⅱ.为测定X的值,取4份60℃的水各50克,分别进行实验,并记录数据如下表:
实验编号 | 实验1 | 实验2 | 实验3 | 实验4 |
NaOH质量/g | 50 | 60 | 70 | 80 |
H2O质量/g | 50 | 50 | 50 | 50 |
溶液质量/g | 100 | 110 | 114.5 | 114.5 |
【实验结果分析】实验1所得溶液的质量分数为 (15) ;由实验可知X的值为 (16) 。
Ⅲ.除去NaOH溶液中混有的少量Ca(OH)2,通过蒸发浓缩、 (17) ,然后过滤、洗涤、干燥得到NaOH固体。
Ⅳ.现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后,恢复到原来温度得到的溶液(乙溶液),甲、乙溶液中溶质质量甲 (18) 乙(填“>、<、=”)。
Ⅴ.在20℃时,向盛有100g水的烧杯中加入111gNaOH,欲使其完全溶解变成不饱和溶液。下列说法中正确的是 (19) 。
A.溶液的质量可能不变 B.溶质的质量分数一定减小
C.溶液中溶质的质量一定增大 D.可以升温到40℃以上
E.NaOH的溶解度一定变大 F.20℃时加入的水的质量>23.4g