题目内容
【题目】向Ba(OH)2溶液中滴入Na2CO3溶液至恰好完全反应,
(1)化学方程式是_____。
(2)可以观察到的实验现象是_____。
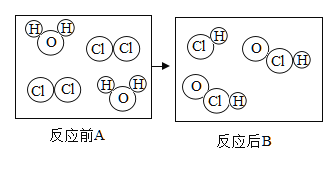
(3)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。(填离子符号):
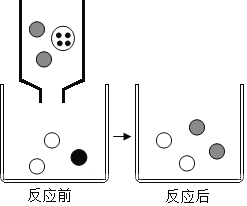
![]() _____;
_____;![]() _____。
_____。
(4)下列物质中能与Ba(OH)2溶液反应产生沉淀的是_____和_____。(双项选择)
A NaNO3 B HCl C MgCl2 D (NH4)2SO4
【答案】![]() 产生白色沉淀 OH- Na+ C D
产生白色沉淀 OH- Na+ C D
【解析】
(1)氢氧化钡能与碳酸钠反应生成碳酸钡和氢氧化钠,该反应的化学方程式为:![]() ;
;
(2)氢氧化钡与碳酸钠反应生成碳酸钡白色沉淀,故观察到的现象是:产生白色沉淀;
(3)向Ba(OH)2溶液中滴入Na2CO3溶液,氢氧化钡溶液中含有钡离子和氢氧根离子,碳酸钠溶液中含有钠离子和碳酸根离子,氢氧化钡与碳酸钠反应生成碳酸钡和氢氧化钠,碳酸钡为沉淀,故反应后,溶液中的离子为钠离子和氢氧根离子,故![]() :OH-、
:OH-、![]() :Na+;
:Na+;
(4)A、硝酸钠与氢氧化钡不反应,无明显现象,不符合题意;
B、氢氧化钡能与HCl反应生成氯化钡和水,无明显现象,不符合题意;
C、氯化镁能与氢氧化钡反应生成氯化钡和氢氧化镁白色沉淀,符合题意;
D、硫酸铵能与氢氧化钡反应生成硫酸钡白色沉淀、氨气和水,符合题意。
故选CD。

【题目】废铁屑主要成分是铁,还有少量铁锈(Fe2O3),硫酸亚铁的生产工艺如图所示。
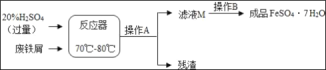
(1)在反应器中除发生Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Fe═3FeSO4这两个反应外,还会发生另外一个反应,化学方程式为:_____,反应器要加强通风,严禁烟火,其原因是:_____。
(2)将成品在有氧条件下焙烧,可转化为Fe2O3、SO2和SO3.为了提高SO3的产率,某实验小组进行了系列探究,实验数据如下:
编号 | 空气通入量/Ls﹣1 | 温度/℃ | SO2产率% | SO3产率/% |
a | 0.02 | 850 | 45.4 | 54.6 |
b | 0.06 | 850 | 30.5 | 69.5 |
c | 0.10 | 810 | 11.1 | 88.9 |
d | 0.10 | 850 | 11.1 | 88.9 |
e | 0.10 | 890 | 11.2 | 88.8 |
①本实验主要研究了哪些因素对SO3产率的影响_____。
②根据上表数据,生产过程中采用实验_____(填编号)的提取条件最合理。
③分析上表数据,空气的通入量对SO3的产率的影响规律是_____。