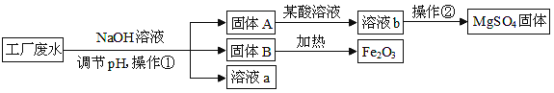
题目内容
【题目】下图是水的净化过程中氯气与水反应生成盐酸和次氯酸的微观模拟图,请回答:
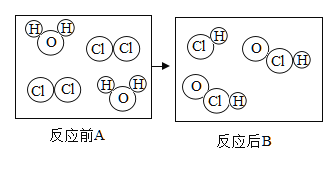
(1)请将 B 图中缺少的粒子补全,使之符合质量守恒定律。________
(2)该反应前后未发生改变的粒子是___________________________________(填名称)。
(3)该反应的化学方程式为_______________________________, 反应前后氯元素的化合价分别为________________________________。
【答案】 氧原子、氯原子和氢原子
氧原子、氯原子和氢原子 ![]() 0、+1、-1
0、+1、-1
【解析】
根据图示可知,氯气与水反应生成次氯酸和盐酸,可写出反应的化学方程式为![]() ;
;
(1)根据质量守恒定律,可以得出反应前有4个氯原子、2个氧原子、4个氢原子,反应后有3个氯原子、2个氧原子和3个氢原子,故B中需要补充一个氯化氢分子,图为
(2)化学反应前后原子的种类不变,该反应前后未发生改变的粒子是氧原子、氯原子和氢原子。
(3)氯气与水反应生成次氯酸和盐酸,反应的化学方程式为![]() ,通常氢元素的化合价是+1价,氧元素的化合价是-2价,设次氯酸中氯元素的化合价是x,氯化氢中氯元素的化合价是y,根据化合物中各元素的化合价代数和为零,则,x=+1,,y=-1,单质中元素的化合价是0,则反应前后氯元素的化合价分别为0、+1、-1。
,通常氢元素的化合价是+1价,氧元素的化合价是-2价,设次氯酸中氯元素的化合价是x,氯化氢中氯元素的化合价是y,根据化合物中各元素的化合价代数和为零,则,x=+1,,y=-1,单质中元素的化合价是0,则反应前后氯元素的化合价分别为0、+1、-1。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
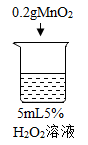
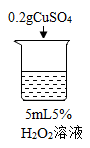
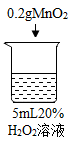
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
(结论与解释)
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰