题目内容
【题目】(5分) 下图是实验室常用的装置。请据图回答:
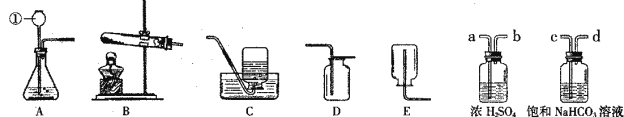
(1)写出仪器①的名称 。收集某气体只能采用E装置,由此推测该气体具有的性质 ;
(2)用高锰酸钾制取氧气的装置组合是 (填序号),反应的化学方程式为 ;
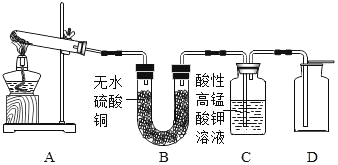
(3)实验室制得的CO2气体中常含有HCl和水蒸气。为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项)。
A.a→b→c→d B.b→a→c→d
C.c→d→a→b D.d→c→b→a
【答案】(5分) (1)长颈漏斗,可溶于水且密度比空气小
(2)B、C或D 2KMnO4 ![]() K2MnO4+MnO2+O2↑ (3)C
K2MnO4+MnO2+O2↑ (3)C
【解析】(1)根据图形写出仪器的名称,根据收集方法推出物质的密度和溶解性.
(2)根据实验室制取氧气的原理和实验装置回答.
(3)根据实验目的和气体的性质以及洗气的方法来选择顺序.
解答:解:(1)仪器的名称是长颈漏斗,该气体只能用向下排空气法收集,说明它密度比空气小,不能用排水法说明它能溶于水.
(2)用高锰酸钾制取氧气需要反应物是固体且需要加热的装置,收集氧气可用排水法和向上排空气法,故选择B、C或D;反应的化学方程式为2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)除去CO2中HCl和水蒸气,要先用碳酸氢钠溶液除氯化氢,后用浓硫酸除水,气体进入洗气瓶时要长管进,短管出,故选C.
答案:(1)长颈漏斗,可溶于水且密度比空气小
(2)B、C或D 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)C

 阅读快车系列答案
阅读快车系列答案【题目】为了测定某碳酸钠样品中杂质氯化钠的质量,李明同学进行了三次实验,反应的化学方程式为:Na2CO3+CaCl2===CaCO3↓+2NaCl。实验数据如下表:
编号 | 第1次 | 第2次 | 第3次 |
所取固体样品的质量/g | 7 | 5 | 5 |
加入氯化钙溶液的质量/g | 50 | 50 | 75 |
反应后生成沉淀的质量/g | 4 | 4 | 4 |
完成下列计算:
(1)碳酸钠样品中碳酸钠的质量是多少?
(2)第三次实验中充分反应后所得溶液中氯化钠的质量分数是多少?