题目内容
【题目】为了测定铁粉样品中铁的质量分数(杂质不含铁元素,不溶于水,也不与其它物质发生反应),进行了如下实验,请回答下列问题:
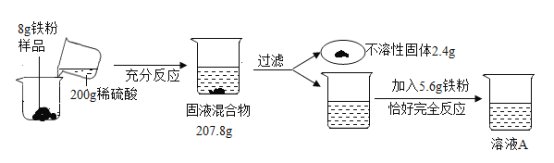
(1)上述实验过程中发生反应的化学方程式为_________________。
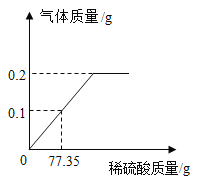
(2)根据已知条件,列出求解加入 5.6g 铁粉时参加反应的稀硫酸中溶质质量(x)的比例式_________________。
(3)此铁粉样品中铁的质量分数为_________。
(4)用 98%的浓硫酸配制 200g 上述稀硫酸,所需浓硫酸的质量为__________________________。
(5)若向反应后的溶液 A 中加入 93.2g 水,所得溶液中溶质的质量分数为______________________。
(6)用 120kg 纯度为 80%的赤铁矿石,不计炼制过程中的损失,能生产出题中上述铁粉样品的质量为________。
【答案】![]()
![]() 70% 20g 10% 96kg
70% 20g 10% 96kg
【解析】
(1)上述实验过程中,铁与稀硫酸反应生成硫酸亚铁和氢气,发生反应的化学方程式为![]() 。
。
(2)加入 5.6g 铁粉恰好与剩余稀硫酸完全反应,,设:加入 5.6g 铁粉时参加反应的稀硫酸中溶质质量为x。
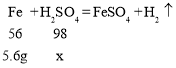
加入 5.6g 铁粉时参加反应的稀硫酸中溶质质量(x)的比例式为![]() 。
。
(3)此铁粉样品中铁的质量分数为![]() 。
。
(4)设8g铁粉样品中铁消耗硫酸的质量为y,则
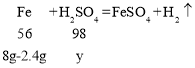
![]()
解得y=9.8g;
后加入5.6g铁粉消耗的硫酸质量为
可知200g稀硫酸中溶质质量为![]() ;用 98%的浓硫酸配制 200g 上述稀硫酸,所需浓硫酸的质量为
;用 98%的浓硫酸配制 200g 上述稀硫酸,所需浓硫酸的质量为![]() 。
。
(5)设加入 5.6g 铁粉恰好与剩余稀硫酸完全反应生成氢气的质量为z,则
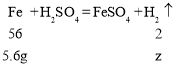
![]()
解得z=0.2g;
根据质量守恒定律,溶液A的质量为207.8g-2.4g+5.6g-0.2g=210.8g;反应后的溶液 A为硫酸亚铁溶液,并硫酸亚铁由两次共11.2g铁与硫酸恰好完全反应得到,设共生成硫酸亚铁的质量为m,则

![]()
解得m=30.4g;
若向反应后的溶液 A 中加入 93.2g 水,所得溶液中溶质的质量分数为![]() 。
。
(6)设用 120kg 纯度为 80%的赤铁矿石,不计炼制过程中的损失,能生产出题中上述铁粉样品的质量为n,则
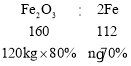
![]()
解得n=96kg;
能生产出题中上述铁粉样品的质量为96kg。

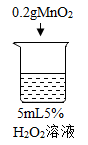
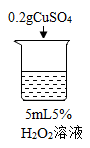
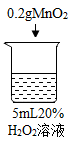
【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
(结论与解释)
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰