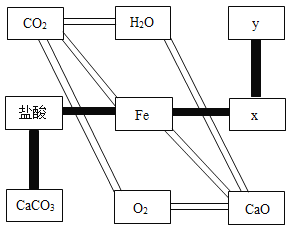
题目内容
【题目】为了探究金属与酸的反应,某兴趣小组进行了以下实验:
(1)A小组研究影响金属与酸反应剧烈程度的因素,如图时20℃时相同质量的铁粉、铁片、铝片分别与足量稀盐酸完全反应,产生氢气的质量与时间的关系图。
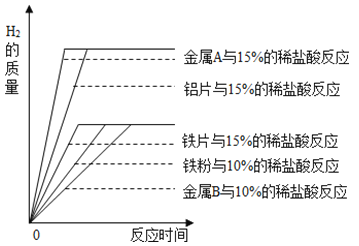
由此分析,归纳出影响金属与酸反应速率的因素有:金属的种类、_____和_____。
(2)金属铬(Cr)越来越受到人们的关注,B小组对Cr、Al、Cu的金属活动性顺序进行了探究,过程如下:
(提出假设)对三种金属的活动性顺序提出假设
a.Al>Cr>Cu b.Cr>Al>Cu c._____
(设计实验)同温下,取大小相同的金属薄片,分别投入到等体积、等浓度的足量稀盐酸中,观察现象,记录如下:
金属 | Cr | Al | Cu |
现象 | 反应缓慢,金属逐渐溶解 | 反应激烈,金属迅速溶解 | 无明显现象 |
(实验条件)实验前,打磨三种金属发生的是_____(填“物理”或“化学”)变化;上述实验使用等浓度的盐酸溶液的理由是_____。
(得出结论)原假设中正确的是_____(填假设中a、b或c),写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式_____。
【答案】金属和酸的接触面积 酸的浓度 Al>Cu>Cr 物理 盐酸浓度不同,影响反应速率 a Cr+2HCl═CrCl2+H2↑
【解析】
(1)由此分析,铝粉、铝片和15%的稀盐酸反应时,铝粉和盐酸的反应速率快,说明接触面积越大,反应速率越快;铁片和15%、5%的盐酸反应时,15%的盐酸和铁反应速率快,因此影响金属与酸反应速率的因素有:金属的种类、金属和酸的接触面积和酸的浓度。
故填:金属和酸的接触面积;酸的浓度。
(2)提出假设:
a.Al>Cr>Cu b.Cr>Al>Cu cAl>Cu>Cr。
故填:Al>Cu>Cr。
实验条件:
实验前,打磨三种金属发生的是物理变化;
上述实验使用等浓度的盐酸溶液的理由是盐酸浓度不同,影响反应速率。
故填:物理;盐酸浓度不同,影响反应速率。
得出结论:
铬和稀盐酸混合:反应缓慢,金属逐渐溶解,说明铬在金属活动性顺序中排在氢前面,铝和稀盐酸混合:反应激烈,金属迅速溶解,说明铝比铬活泼,铜和稀盐酸混合无明显现象,说明铜排在金属活动性顺序中氢的后面,即铬比铜活泼,因此原假设中正确的是a,铬(铬与盐酸反应后显+2价)与盐酸反应生成二氯化铬和氢气,反应的化学方程式:![]() 。
。
故填:a;![]() 。
。

 字词句篇与同步作文达标系列答案
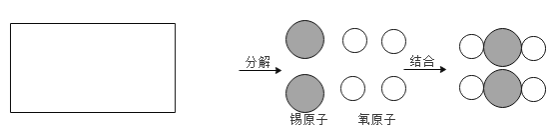
字词句篇与同步作文达标系列答案【题目】如下表所示,已知A与一定量的B反应生成C和D。
物质 | A | B | C | D |
|
微观示意图 |
|
|
|
|
(1)参加反应的A和B个数比为_____。
(2)该反应中化合价升高的元素是_____。
(3)若在该反应中继续通入B,则D会与B继续反应产生一种氮肥,请写出此时A与B反应的总化学方程式:_____。
【题目】取25g大理石与200g稀盐酸恰好完全反应。反应过程中剩余固体的质量与反应时间的关系如下表:
反应时间/s | t1 | t2 | t3 | t4 |
剩余固体的质量/g | 20 | 10 | 5 | 5 |
试完成以下计算:
(1)25g样品中含碳酸钙的质量为_______________g。
(2)反应后生成氯化钙的质量______________。
(3) 大理石中碳酸钙的质量分数_________________(保留1位小数)。