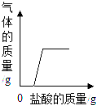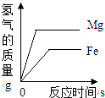题目内容
【题目】同学们设计了如图的“化学键盘”,九个键分别代表不同的物质。
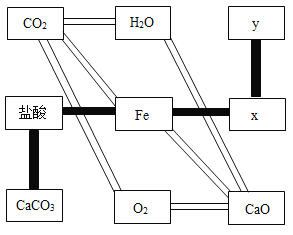
(1)己知的七种物质中,属于非金属单质的是_____。
(2) Fe与盐酸反应的化学方程式为______________。
(3)“化学键盘”的解锁规则是:若连线两端物质之间能发生反应,则此次滑动成功有效。同学们设计了两种解锁方式:
①从左下角的CaCO3出发,依次经过盐酸、Fe、x,最终到达y,滑动四次,解锁成功。请写出图中x(氯化物)、y(盐)的化学式:x_____,y_____。
②从左上角的CO2出发,滑动两次,到达右下角的CaO,解锁成功。请在图中将你认为可以解锁的一条通道涂黑或画斜纹线_____,并写出其中一个反应的化学方程式:_____。
【答案】O2 Fe+2HCl=FeCl2+H2↑ CuCl2 AgNO3 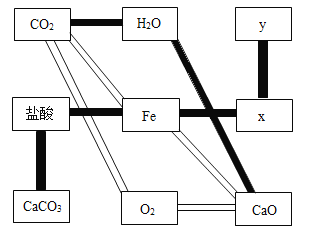 CO2+H2O=H2CO3或CaO+H2O=Ca(OH)2
CO2+H2O=H2CO3或CaO+H2O=Ca(OH)2
【解析】
(1)由题意可知,已知的七种物质中,属于非金属单质的是氧气,化学式是:O2。
(2)Fe与盐酸反应生成了氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl=FeCl2+H2↑。
(3)①由于碳酸钙能与盐酸反应,盐酸能与铁反应,铁能够与氯化铜反应,氯化铜能与硝酸银反应生成氯化银沉淀和硝酸铜,所以从左下角的CaCO3出发,依次经过盐酸、Fe、x,最终到达y,滑动四次,解锁成功。所以图中x、y的化学式是:CuCl2、AgNO3。
②由于二氧化碳能与水化合生成了碳酸,水能与氧化钙化合生成了氢氧化钙,所以,从左上角的CO2出发,滑动两次,到达右下角的CaO,解锁成功。解锁的一条通道如下图:

其中二氧化碳能与水化合生成了碳酸的化学方程式是:CO2+H2O=H2CO3;氧化钙与水反应生成氢氧化钙的化学方程式是:CaO+H2O=Ca(OH)2。

【题目】为了探究金属与酸的反应,某兴趣小组进行了以下实验:
(1)A小组研究影响金属与酸反应剧烈程度的因素,如图时20℃时相同质量的铁粉、铁片、铝片分别与足量稀盐酸完全反应,产生氢气的质量与时间的关系图。
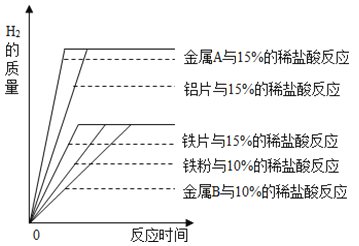
由此分析,归纳出影响金属与酸反应速率的因素有:金属的种类、_____和_____。
(2)金属铬(Cr)越来越受到人们的关注,B小组对Cr、Al、Cu的金属活动性顺序进行了探究,过程如下:
(提出假设)对三种金属的活动性顺序提出假设
a.Al>Cr>Cu b.Cr>Al>Cu c._____
(设计实验)同温下,取大小相同的金属薄片,分别投入到等体积、等浓度的足量稀盐酸中,观察现象,记录如下:
金属 | Cr | Al | Cu |
现象 | 反应缓慢,金属逐渐溶解 | 反应激烈,金属迅速溶解 | 无明显现象 |
(实验条件)实验前,打磨三种金属发生的是_____(填“物理”或“化学”)变化;上述实验使用等浓度的盐酸溶液的理由是_____。
(得出结论)原假设中正确的是_____(填假设中a、b或c),写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式_____。