题目内容
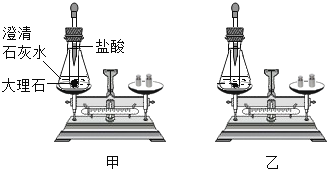
【题目】取25g大理石与200g稀盐酸恰好完全反应。反应过程中剩余固体的质量与反应时间的关系如下表:
反应时间/s | t1 | t2 | t3 | t4 |
剩余固体的质量/g | 20 | 10 | 5 | 5 |
试完成以下计算:
(1)25g样品中含碳酸钙的质量为_______________g。
(2)反应后生成氯化钙的质量______________。
(3) 大理石中碳酸钙的质量分数_________________(保留1位小数)。
【答案】20g 22.2g 80.0%
【解析】
(1)根据表中的数据可知,大理石中杂质的质量为5g,含碳酸钙的质量为:25g-5g-20g;
(2)设生成的氯化钙的质量为x。
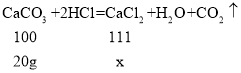
![]() ,x=22.2g ;
,x=22.2g ;
(3)大理石中碳酸钙的质量分数=![]() 。
。
答:(1)25g样品中含碳酸钙的质量为20g;
(2)反应后生成氯化钙的质量22.2g;
(3)大理石中碳酸钙的质量分数80.0%。

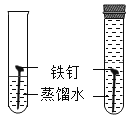
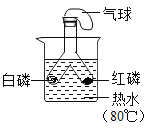
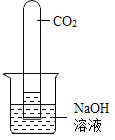
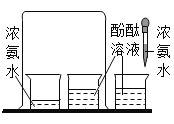
【题目】实验探究是化学学习的重要方法,下列对比实验设计能实现相应实验目的的是( )
选项 | A | B | C | D |
实验目的 | 探究铁锈蚀条件 | 探究燃烧三个条件 | 证明CO2与NaOH反应 | 探究分子运动 |
实验设计 |
|
|
|
|
A.AB.BC.CD.D
【题目】为了探究金属与酸的反应,某兴趣小组进行了以下实验:
(1)A小组研究影响金属与酸反应剧烈程度的因素,如图时20℃时相同质量的铁粉、铁片、铝片分别与足量稀盐酸完全反应,产生氢气的质量与时间的关系图。
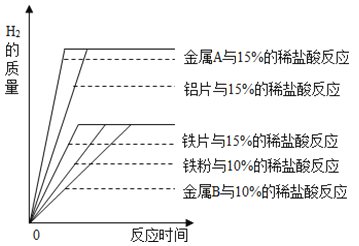
由此分析,归纳出影响金属与酸反应速率的因素有:金属的种类、_____和_____。
(2)金属铬(Cr)越来越受到人们的关注,B小组对Cr、Al、Cu的金属活动性顺序进行了探究,过程如下:
(提出假设)对三种金属的活动性顺序提出假设
a.Al>Cr>Cu b.Cr>Al>Cu c._____
(设计实验)同温下,取大小相同的金属薄片,分别投入到等体积、等浓度的足量稀盐酸中,观察现象,记录如下:
金属 | Cr | Al | Cu |
现象 | 反应缓慢,金属逐渐溶解 | 反应激烈,金属迅速溶解 | 无明显现象 |
(实验条件)实验前,打磨三种金属发生的是_____(填“物理”或“化学”)变化;上述实验使用等浓度的盐酸溶液的理由是_____。
(得出结论)原假设中正确的是_____(填假设中a、b或c),写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式_____。