��Ŀ����
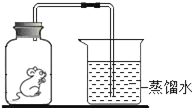
����Ŀ�������ճ������У�ʳ�õ�ʳ�δ�����Ժ�ˮ��ɹ����ˮ�������ᾧ��ɻ�ú���������ɳ�����ʵĴ��Σ�
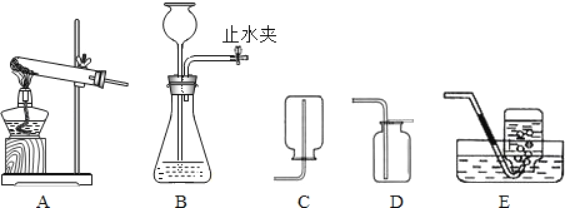
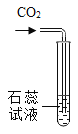
��1��Ϊ�˳�ȥ�����к��е�������ɳ��ijС���������ͼ��ʾ��ʵ�飺�ڴ����ᴿ�Ĺ����У���ȷ�IJ���˳����(�����)______��
��2����������ʱ��Ϊ�����ۺõ���ֽ����©���ڣ�Ӧ������������__________��
��3��ʵ��С��ʵ���������£�
��ȡ����/g | �ܽ����/g | ʣ�����/g | ����/g | ���β���/% |
5.0 | 3.6 | 1.4 | 2.8 | �� |
��ͬѧ�ľ��β���Ϊ��_______ ��������������
��4��ijͬѧ���õIJ���������ͬѧ�Ƚ�����ƫ�ͣ�������Щ������²�������ƫ��______(ѡ����ĸ���)
A���ܽ�ʱ��5.0g����һ��ȫ������10mLˮ�У���������
B������ʱ������Һ�塢���彦��
C���ᴿ��ľ�����δ��ȫ����ͳ�������
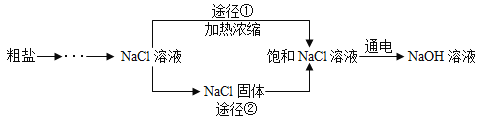
��5�������ᴿ��õ������������л�������������������CaCl2��MgCl2��ʵ��С���ͬѧ���������ʵ�鷽������ȥ���������ʣ�
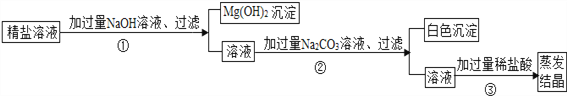
�ٲ���ٵĻ�ѧ����ʽΪ___________��
�ڲ�����еİ�ɫ����Ϊ___________��
�۲�����м�ϡ������Ϊ�˳�ȥ��Һ��_____________��
���𰸡�CBA ��ˮ��ʪ��ѹ����û������ 78% AB MgCl2+2NaOH=2NaCl+Mg��OH��2�� CaCO3 ������̼���ƺ���������
��������
��1���ڴ����ᴿ�Ĺ����У���ȷ�IJ���˳�����ܽ�C������B������A��
��2����������ʱ��Ϊ�����ۺõ���ֽ����©���ڣ�Ӧ����ˮ��ʪ��ѹ����û�����ݣ�
��3����ͬѧ�ľ��β���Ϊ��2.8g/3.6g��100%=78%��
��4��A���ܽ�ʱ��5.0g����һ��ȫ������10mLˮ�У���������ʱ���Ȼ��Ʋ�����ȫ�ܽ⣬�ᵼ�¾�������ƫС���Ӷ����²���ƫ�ͣ�
B������ʱ������Һ�塢���彦�������¾�������ƫС���Ӷ����²���ƫ�ͣ�
C���ᴿ��ľ�����δ��ȫ����ͳ������������¾�������ƫ�Ӷ����²���ƫ�ߣ�
��5���ٲ�����У��Ȼ�þ���������Ʒ�Ӧ����������þ�������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaOH=2NaCl+Mg��OH��2����
�ڲ������̼���ƺ��Ȼ��Ʒ�Ӧ���ɰ�ɫ����̼��ƣ�
�۲�����м�ϡ������Ϊ�˳�ȥ��Һ�й�����̼���ƺ��������ơ�

 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д� ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д�����Ŀ������ʵ�鷽�������������һ�µ���
��Ŀ | A | B | C | D |
���� |
|
|
|
|
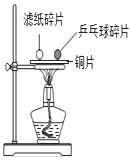
���� | ����ƿ��������ƿ��� | ��ȼij��������ձ��ڱڳ�����ɫҺ�Σ�����ʯ��ˮ����� | ��ɫʯ����Һ��ͨ�������̼���� | ƹ������Ƭ��ȼ�գ���ֽ��Ƭ��ȼ�� |
���� | CO2������ˮ����ˮ��Ӧ | ��������һ����̼Ԫ�ء���Ԫ�غ���Ԫ�� | ʹʯ������Ƕ�����̼ | ˵��ȼ������֮һ���¶ȴﵽ�Ż�� |
A. AB. BC. CD. D