题目内容
【题目】某白色固体由硫酸钡、碳酸钙、碳酸钠、氢氧化钙中的三种物质组成。为确定其成分,某同学设计并完成如下实验。请把表格中的内容补充完整。
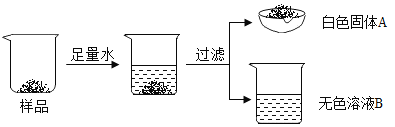
实验操作 | 实验现象 | 结论或解释 | |
① | 取少量白色固体A于试管中,滴加足量稀盐酸 | 有气泡产生 固体有剩余 | 原白色固体中含有__(用化学式表示) |
② | 取少量无色溶液B于试管中,滴加足量稀盐酸 | 有气泡产生 | 原白色固体中含有碳酸钠,生成气体的化学方程式为___ |
③ | 取少量无色溶液B于试管中,先滴加酚酞试液,再加入____ | _ | 原白色固体中含有碳酸钙 |
【答案】BaSO4 Na2CO3+ 2HCl=2NaCl+H2O +CO2↑ 过量(或足量)氯化钙溶液(或氯化钡、硝酸钙、硝酸钡溶液 )(化学式表示要正确) 产生白色沉淀,溶液从无色变红色,再变无色(或溶液最终显无色1分)
【解析】
(1)硫酸钡是不容于酸的沉淀,碳酸钙沉淀可与酸反应而溶解。白色固体A中加入足量的盐酸,现象是有气泡产生,说明固体溶于水后有碳酸钙存在,但是不确定来源,可能是固体中原有的,也可能是样品中同时有碳酸钠和氢氧化钙,在溶于水的过程中生成的。固体有剩余,原白色固体中含有BaSO4;因为BaSO4为不溶于酸的固体,故含有BaSO4;
(2)少量无色溶液B中加入足量的盐酸,现象是有气泡产生,原白色固体中含有Na2CO3,碳酸钠和盐酸反应生成氯化钠和水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)少量无色溶液B中先加入酚酞试液,因为碳酸钠一定存在,溶液显碱性,酚酞试液变红。同时加入酚酞试液是为了检验无色溶液B中是否含有OH-,从而证明原白色固体中是否有Ca(OH)2,所以需要加入过量的CaCl2溶液除去无色溶液B中NaCO3带来的干扰,然后,根据溶液的颜色来判断是否有Ca(OH)2,若最终溶液为红色,则证明有Ca(OH)2;若最终溶液为无色,则证明没有Ca(OH)2,有CaCO3;故答案为:过量的CaCl2溶液;无。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案