��Ŀ����
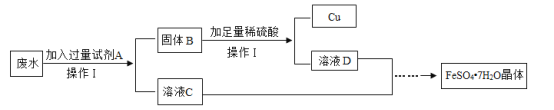
����Ŀ�����÷Ͼɵ��ͭñ����Cu��Zn����ȡ����ͭ��Cu�������õ�����п��ҺE����Ҫ��������ͼ��ʾ����Ӧ��������ȥ����
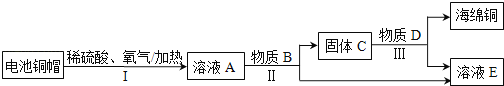
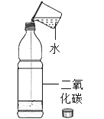
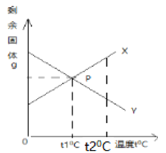
��1������I�лᷢ����2Cu+2H2SO4+O2![]() 2CuSO4+2X��X�Ļ�ѧʽΪ_____��
2CuSO4+2X��X�Ļ�ѧʽΪ_____��
��2�����̢����ȼ������B����ַ�Ӧ���ٽ��з��룮���������������_____�����˸ò������õ��IJ����������ձ�����������_____����������������_____��
��3������D��һ���ᣬ���̢�Ӧ�Ļ�ѧ����ʽΪ_____���жϹ���C�еķ�ͭ���ʱ�����D��Ӧ��ȫ�������ǣ���������Dʱ��_____��
��4��A��E�к�ͭ��п����Ԫ�ص���_____������ĸ��ţ���
���𰸡�H2O ���� ©�� ���� Zn+H2SO4=ZnSO4+H2�� �������� AC
��������
��1���ɻ�ѧ����ʽ��֪��ǰ����2��ͭԭ�ӣ�4����ԭ�ӣ�2����ԭ�Ӻ�10����ԭ�ӣ�����2��ͭԭ�ӣ�2����ԭ�Ӻ�8����ԭ�ӣ����������غ㶨�ɣ���ȱ��4����ԭ�Ӻ�2����ԭ�Ӵ�����2X�У���X�Ļ�ѧʽΪH2O������H2O��
��2���ò�����������Һ������˷��룬����Ϊ���ˣ�������ˣ�
����ʱ�õ��IJ��������У��ձ���©����������������©����
����ʱ������������������������������
��3������D��һ���ᣬ�����C��Ӧ��������п������DΪϡ���ᣬ��C�ǽ���п����Ӧ��������п���������ʷ�Ӧ�Ļ�ѧ����ʽдΪ��Zn+H2SO4=ZnSO4+H2����
����C�еķ�ͭ����Ϊп�����п��ȫ��Ӧ��������D��ϡ���ᣩʱ���������ɣ��������������ɡ�
��4���ɷ�Ӧʾ��ͼ��֪����ҺA�к�������п������ͭ��Ϊ�õ�����п������ҺA�м��������п��B���������C�к��з�Ӧ���ɵ�ͭ������п������AC��

����Ŀ������ʵ�鷽�����ܴﵽʵ��Ŀ���ǣ� ��
��� | A | B | C | D |
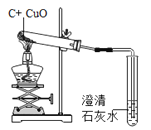
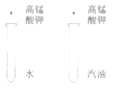
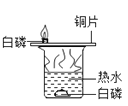
Ŀ�� | ֤��������̼����ˮ���ܺ�ˮ��Ӧ | ֤��̼������ͭ�ܷ�����Ӧ | ̽��ͬ�������ڲ�ͬ���ܼ����ܽ��� | ̽��ȼ�յ�������ȼ����Ҫ���� |
���� |
|
|
|
|
A. AB. BC. CD. D