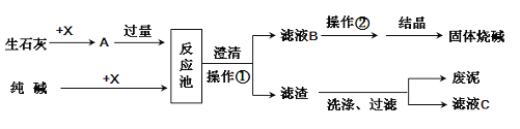
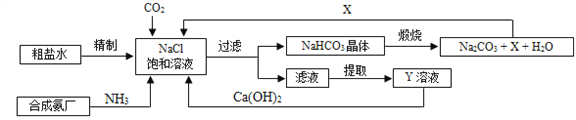
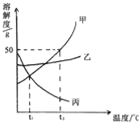
题目内容
【题目】科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为4NH3+ 3O2![]() 2X + 6H2O,则X的化学式为
2X + 6H2O,则X的化学式为
A. NO B. N2 C. NO2 D. N2O
【答案】B
【解析】试题分析:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式4NH3+3O2![]() 2X+6H2O,反应前氮、氢、氧原子个数分别为4、12、6,反应后的生成物中氮、氢、氧原子个数分别为0、12、6,根据反应前后原子种类、数目不变,则2X分子中含有6个氮原子,则每个X分子由2个氮原子构成,则物质X的化学式为N2.
2X+6H2O,反应前氮、氢、氧原子个数分别为4、12、6,反应后的生成物中氮、氢、氧原子个数分别为0、12、6,根据反应前后原子种类、数目不变,则2X分子中含有6个氮原子,则每个X分子由2个氮原子构成,则物质X的化学式为N2.
故选:B.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
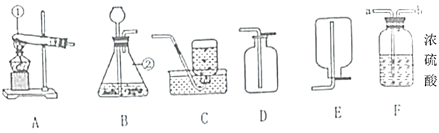
小学生10分钟应用题系列答案【题目】科学探究是学生积极主动获取化学知识、认识和解决化学问题的重要实践活动。下面呈现的是某实验小组在课堂上做的一组探究实验:
(1)在a试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察到的现象是______。
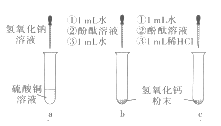
(2)向b、c两支试管中各加入相同质量的氢氧化钙粉末(用药匙的柄把一端挑一点),然后各加入1mL水,振荡,呈浑浊状,静置,再各滴人1~2 滴酚酞溶液,观察到两试管溶液均变红。继续向b试管中加入约1mL水,振荡;向c试管中加人约1mL稀盐酸,振荡。发现b试管变澄清,溶液仍呈红色,c试管变澄清,溶液变成无色。根据上述实验可验证氢氧化钙的哪些性质_______(写出一点即可),向b试管中第二次加入约1mL水的作用是______。
【提出问题】试管c中加入约1mL稀盐酸后,溶液中的溶质是什么?
【查阅资料】查阅资料:CaCl2溶液呈中性。
【猜想假设】小丽猜想:I.CaCl2Ⅱ.CaCl2和HClⅢ.CaCl2和Ca(OH)2
【反思质疑】小明对猜想_______产生质疑,理由是_______
【进行实验】小组同学通过交流,设计如下实验方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
取少量c试管中的溶液于试管中,______________ | ________ | 猜想Ⅱ成立 |
实验结束,小组同学将a、b、c三支试管中的剩余物质混合,发现废液呈浑浊。
【问题与交流】废液中大量存在的阳离子有_______。写出废液中可能发生反应的一个化学方程式_______。