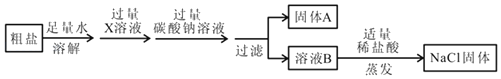
题目内容
【题目】某小组同学在镁条与CuSO4溶液反应的实验中,除了观察到镁条上有红色物质析出,还观察到有无色无味气体产生及溶液中有沉淀生成。他们在查阅资料的基础上,针对以上实验现象进一步开展探究。

(查阅资料)
i. 氢氧化铜和碱式硫酸铜[Cu2(OH)2SO4]均难溶于水;在溶液pH < 2时,能与稀硫酸发生如下反应:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu2 (OH)2SO4 + H2SO4 = 2CuSO4 + 2H2O
ii. 镁、铜均能与浓硝酸反应:
Mg+4HNO3=Mg(NO3)2(溶液为无色)+2NO2↑(红棕色)+2H2O
Cu+4HNO3=Cu(NO3)2(溶液为蓝色)+2NO2↑(红棕色)+2H2O
(提出假设)
I.镁条上的红色物质是金属铜。
II.无色无味气体是_____。
III.溶液中生成的沉淀可能是氢氧化铜,也可能是碱式硫酸铜或二者的混合物。
(进行实验)
序号 | 实验操作 | 实验现象及数据 | 实验结论 |
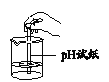
1 | 取10 mL 10% CuSO4溶液于试管中,测定 溶液pH | pH 约为3.4 | —— |
2 | 向实验1试管中加入足量打磨光亮的镁条 | 产生无色无味气体,镁条表面附着红色物质,溶液中出现沉淀 | |
3 | 将实验2中得到的附着红色物质的镁条放入试管中,加入浓硝酸 | _____ | 假设I成立 |
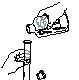
4 | 用小试管收集实验2中产生的气体,用拇指堵住集满气体的小试管管口,靠近酒精灯火焰,移开拇指 | 尖锐的爆鸣声,试管内壁有无色液滴 | 假设II成立 |
5 | 重复实验2,过滤、收集溶液中的沉淀,晾干,备用 | —— | —— |
6 | 取2支试管,分别标记为试管甲和试管乙,向试管甲中加入1 g_____,向试管乙中加入1 g_____;再分别向2支试管中加入5 g溶质的质量分数为10%的稀硫酸 | 试管甲中固体全部溶解,试管乙中仍有固体剩余 | 沉淀是碱式硫酸铜 |
(解释与结论)
(1)镁条与硫酸铜发生置换反应的化学方程式是_____。
(2)由实验1现象可知,CuSO4溶液呈_____(填“酸”“碱”或“中”)性。
(3)实验3中,观察到的现象是_____。
(4)根据实验4补全假设II:_____。
(5)试管甲、试管乙中加入的物质分别是_____、_____(填字母序号)。
A 氢氧化铜 B 实验5中得到的固体
(反思与评价)
(6)有同学认为根据实验6数据和现象得出“沉淀是碱式硫酸铜”结论不正确。正确的结论应为_____。
【答案】Mg+CuSO4=Cu+MgSO4 酸 附着红色物质的镁条溶解,溶液变为蓝色,产生红棕色气体 H2 B A 沉淀可能是碱式硫酸铜,也可能是碱式硫酸铜和氢氧化铜的混合物
【解析】
(1)镁条与硫酸铜发生置换反应生成硫酸镁和铜,化学方程式是Mg+CuSO4=MgSO4+Cu;(2)由实验1现象pH约为3.4,可以知道CuSO4溶液呈酸性;
(3)实验3中假设I成立,根据题中提供信息“镁、铜均能与浓硝酸反应生成红棕色NO2、硫酸铜、硫酸镁和水”,则可以观察到的现象是红色固体溶解,产生红棕色气体,溶液变成蓝色;
(4)用小试管收集实验2中产生的气体,用拇指堵住集满气体的小试管管口,靠近酒精灯火焰,移开拇指,会听到尖锐的爆鸣声,试管内壁有无色液滴,说明假设II是产生氢气;
(5)
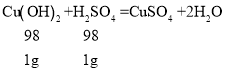
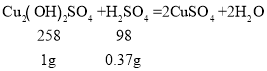 试管甲、试管乙中加入的物质分别是实验5中得到的固体和氢氧化铜,故填:B、A。
试管甲、试管乙中加入的物质分别是实验5中得到的固体和氢氧化铜,故填:B、A。
(6)有同学认为根据实验6数据和现象得出“沉淀是碱式硫酸铜”结论不正确,因为沉淀可能是碱式硫酸铜,也可能是碱式硫酸铜和氢氧化铜的混合物。

 阅读快车系列答案
阅读快车系列答案【题目】钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂主要成分为碳酸钙,现将100g盐酸分成5等份,逐次加到用40g该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象。请根据有关信息回答问题:
序号 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 35 | 30 | 25 | 20 | a |
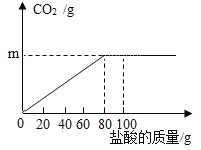
(1)a的数值为___,该品牌补钙药剂中CaCO3的质量分数是___。
(2)求该盐酸中溶质的质量分数____。(写出计算过程,计算结果保留一位小数)
(3)如果在配制该盐酸时质量分数偏小了,对该品牌补钙药剂中CaCO3的质量分数计算是否有影响。你的看法是___。