题目内容
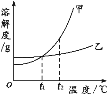
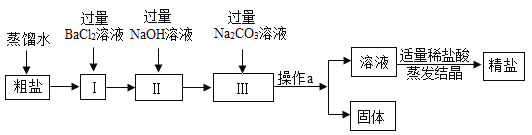
【题目】钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂主要成分为碳酸钙,现将100g盐酸分成5等份,逐次加到用40g该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象。请根据有关信息回答问题:
序号 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 35 | 30 | 25 | 20 | a |
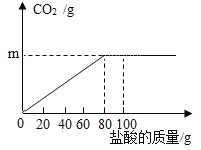
(1)a的数值为___,该品牌补钙药剂中CaCO3的质量分数是___。
(2)求该盐酸中溶质的质量分数____。(写出计算过程,计算结果保留一位小数)
(3)如果在配制该盐酸时质量分数偏小了,对该品牌补钙药剂中CaCO3的质量分数计算是否有影响。你的看法是___。
【答案】20 50% 18.3% 没有,该品牌补钙药剂中CaCO3的质量分数计算与盐酸的溶质的质量分数大小无关
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
(1)根据图和表可知,第四次时两者恰好完全反应,第五次固体不再减少,为杂质,a=20g,该品牌补钙药剂中CaCO3的质量分数为![]()
(2)第4次加入稀盐酸后完全反应,设该盐酸中溶质的质量分数为x
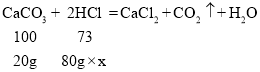
![]()
![]()
(3)如果在配制该盐酸时质量分数偏小了,对品牌补钙药剂中CaCO3的质量分数计算没有影响,品牌补钙药剂中CaCO3的质量分数计算与盐酸的溶质的质量分数大小无关。

【题目】某小组同学在镁条与CuSO4溶液反应的实验中,除了观察到镁条上有红色物质析出,还观察到有无色无味气体产生及溶液中有沉淀生成。他们在查阅资料的基础上,针对以上实验现象进一步开展探究。

(查阅资料)
i. 氢氧化铜和碱式硫酸铜[Cu2(OH)2SO4]均难溶于水;在溶液pH < 2时,能与稀硫酸发生如下反应:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu2 (OH)2SO4 + H2SO4 = 2CuSO4 + 2H2O
ii. 镁、铜均能与浓硝酸反应:
Mg+4HNO3=Mg(NO3)2(溶液为无色)+2NO2↑(红棕色)+2H2O
Cu+4HNO3=Cu(NO3)2(溶液为蓝色)+2NO2↑(红棕色)+2H2O
(提出假设)
I.镁条上的红色物质是金属铜。
II.无色无味气体是_____。
III.溶液中生成的沉淀可能是氢氧化铜,也可能是碱式硫酸铜或二者的混合物。
(进行实验)
序号 | 实验操作 | 实验现象及数据 | 实验结论 |
1 | 取10 mL 10% CuSO4溶液于试管中,测定 溶液pH | pH 约为3.4 | —— |
2 | 向实验1试管中加入足量打磨光亮的镁条 | 产生无色无味气体,镁条表面附着红色物质,溶液中出现沉淀 | |
3 | 将实验2中得到的附着红色物质的镁条放入试管中,加入浓硝酸 | _____ | 假设I成立 |
4 | 用小试管收集实验2中产生的气体,用拇指堵住集满气体的小试管管口,靠近酒精灯火焰,移开拇指 | 尖锐的爆鸣声,试管内壁有无色液滴 | 假设II成立 |
5 | 重复实验2,过滤、收集溶液中的沉淀,晾干,备用 | —— | —— |
6 | 取2支试管,分别标记为试管甲和试管乙,向试管甲中加入1 g_____,向试管乙中加入1 g_____;再分别向2支试管中加入5 g溶质的质量分数为10%的稀硫酸 | 试管甲中固体全部溶解,试管乙中仍有固体剩余 | 沉淀是碱式硫酸铜 |
(解释与结论)
(1)镁条与硫酸铜发生置换反应的化学方程式是_____。
(2)由实验1现象可知,CuSO4溶液呈_____(填“酸”“碱”或“中”)性。
(3)实验3中,观察到的现象是_____。
(4)根据实验4补全假设II:_____。
(5)试管甲、试管乙中加入的物质分别是_____、_____(填字母序号)。
A 氢氧化铜 B 实验5中得到的固体
(反思与评价)
(6)有同学认为根据实验6数据和现象得出“沉淀是碱式硫酸铜”结论不正确。正确的结论应为_____。
【题目】碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业。某化学兴趣小组的同学对碳酸氢钠的性质进行了如下探究。
实验一:探究碳酸氢钠溶液的酸碱性用pH试纸测得碳酸氢钠溶液的pH=10,由此可知:当向碳酸氢钠溶液中滴加紫色的石蕊试液时,溶液呈_______色。
实验二:探究碳酸氢钠的热稳定性
[查阅资料]:碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
[进行实验]:为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如下图所示。

(1)加热一段时间后,观察到烧杯内壁有_______________。
(2)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是____________________________。
②为探究反应后的固体产物到底是NaOH还是Na2CO3,他们又进行了如下表的实验并得到结论,请你完成下表。
实 验 操 作 | 实验现象 | 结 论 |
_______________ | ____________ | 固体产物是Na2CO3 |