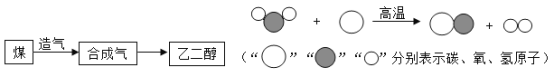
题目内容
【题目】水是人类宝贵的自然资源,请结合水的有关知识回答。
(1)通过电解水的实验可得出,水是由___组成的,电解水的化学方程式是___。
(2)自来水厂生产自来水时,不需要使用的净水方法是___(填字母序号)。
A 沉淀 B 过滤 C 吸附 D 蒸馏
(3)生活中常用___来区分硬水和软水,生活中常用___的方法将硬水转化为软水。
(4)爱护水资源,人人有责。请写出一条节约用水的措施___。
【答案】氢、氧元素 2H2O![]() 2H2↑+O2↑ D 肥皂水 煮沸 淘米水浇花
2H2↑+O2↑ D 肥皂水 煮沸 淘米水浇花
【解析】
(1)电解水的实验生成了氢气和氧气,则水是由氢、氧元素组成的,电解水的化学方程式是2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。
(2)自来水厂生产自来水的流程为取水、沉降、过滤、杀菌消毒、配水,则不需要使用的净水方法是蒸馏,故选D。
(3)生活中常用肥皂水来区分硬水和软水,产生泡沫少的是硬水,产生的泡沫少的是软水,生活中常用煮沸的方法将硬水转化为软水。
(4)爱护水资源,人人有责,节约用水的措施有很多,例如淘米水浇花、使用节水器具等。

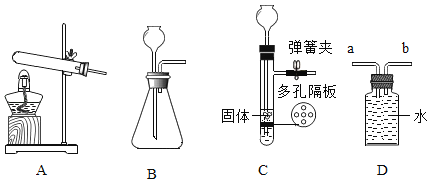
【题目】某小组同学在镁条与CuSO4溶液反应的实验中,除了观察到镁条上有红色物质析出,还观察到有无色无味气体产生及溶液中有沉淀生成。他们在查阅资料的基础上,针对以上实验现象进一步开展探究。

(查阅资料)
i. 氢氧化铜和碱式硫酸铜[Cu2(OH)2SO4]均难溶于水;在溶液pH < 2时,能与稀硫酸发生如下反应:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu2 (OH)2SO4 + H2SO4 = 2CuSO4 + 2H2O
ii. 镁、铜均能与浓硝酸反应:
Mg+4HNO3=Mg(NO3)2(溶液为无色)+2NO2↑(红棕色)+2H2O
Cu+4HNO3=Cu(NO3)2(溶液为蓝色)+2NO2↑(红棕色)+2H2O
(提出假设)
I.镁条上的红色物质是金属铜。
II.无色无味气体是_____。
III.溶液中生成的沉淀可能是氢氧化铜,也可能是碱式硫酸铜或二者的混合物。
(进行实验)
序号 | 实验操作 | 实验现象及数据 | 实验结论 |
1 | 取10 mL 10% CuSO4溶液于试管中,测定 溶液pH | pH 约为3.4 | —— |
2 | 向实验1试管中加入足量打磨光亮的镁条 | 产生无色无味气体,镁条表面附着红色物质,溶液中出现沉淀 | |
3 | 将实验2中得到的附着红色物质的镁条放入试管中,加入浓硝酸 | _____ | 假设I成立 |
4 | 用小试管收集实验2中产生的气体,用拇指堵住集满气体的小试管管口,靠近酒精灯火焰,移开拇指 | 尖锐的爆鸣声,试管内壁有无色液滴 | 假设II成立 |
5 | 重复实验2,过滤、收集溶液中的沉淀,晾干,备用 | —— | —— |
6 | 取2支试管,分别标记为试管甲和试管乙,向试管甲中加入1 g_____,向试管乙中加入1 g_____;再分别向2支试管中加入5 g溶质的质量分数为10%的稀硫酸 | 试管甲中固体全部溶解,试管乙中仍有固体剩余 | 沉淀是碱式硫酸铜 |
(解释与结论)
(1)镁条与硫酸铜发生置换反应的化学方程式是_____。
(2)由实验1现象可知,CuSO4溶液呈_____(填“酸”“碱”或“中”)性。
(3)实验3中,观察到的现象是_____。
(4)根据实验4补全假设II:_____。
(5)试管甲、试管乙中加入的物质分别是_____、_____(填字母序号)。
A 氢氧化铜 B 实验5中得到的固体
(反思与评价)
(6)有同学认为根据实验6数据和现象得出“沉淀是碱式硫酸铜”结论不正确。正确的结论应为_____。
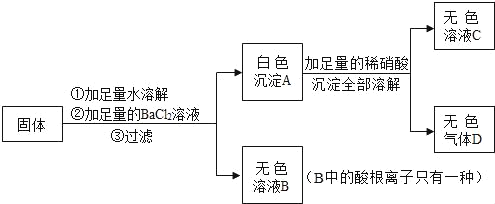
【题目】石灰石是常用的建筑材料。化学小组同学取一定量石灰石高温煅烧一段时间,冷却后,对剩余固体成分进行如下探究。
(1)写出石灰石高温煅烧的化学方程式___。
(2)根据化学方程式进行猜想。固体残留物成分:
I.只有氧化钙;II.只有碳酸钙;III.___
(3)甲乙丙三位同学分别设计了实验探究煅烧后固体成分。
友情提示:氯化钙溶液呈中性。
①甲同学取一定量的剩余固体于试管中,加入一定量的水振荡,用温度传感器测出溶液的温度,结果如图。则固体物质中一定含有___,用化学方程式解释判断的理由___。

②乙同学取一定量的剩余固体于试管中,加入足量的稀盐酸,待充分反应后,滴加酚酞试液,溶液呈无色。乙同学据此认为试管中的固体只有碳酸钙,即猜想 II成立。该同学设计方案是否合理,理由是___。
③丙同学利用水、无色酚酞溶液和稀盐酸证明了猜想III成立,请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量剩余固体于试管中,加水振荡,过滤。 | 猜想III成立 | |
___ | ___ | |
___ | ___ |