题目内容
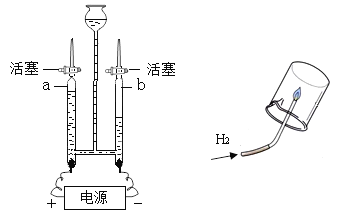
【题目】某化学实验小组的同学利用如图所示装置进行实验:
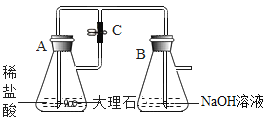
(1)A中反应开始时,弹簧夹C处于打开状态,B中反应的化学方程式为_____。
(2)一段时间后,关闭C,装置A中仍在反应,过一会儿,观察到装置B中出现白色沉淀。小组同学探究反应后装置B中的溶液的溶质成分。
(提出问题)反应后装置B中溶液的溶质成分是什么?
(猜想与假设)猜想1:NaCl、HCl 猜想2:NaCl、CaCl2
猜想3:NaCl、NaOH 猜想4:NaCl、NaOH、Na2CO3
(交流讨论)经讨论,大家一致认为猜想_____一定不合理。
(实验探究)将反应后装置B中所得混合物过滤,取少量滤液分别进行如下实验:
实验1:向滤液中滴加碳酸钠溶液,无明显现象,则猜想_____不正确。
实验2:请根据表中内容填写;
实验提供的药品有:酚酞溶液、稀盐酸、Ba(OH)2溶液、BaC12溶液。
实验操作 | 先向滤液中加入过量_____ | 再向滤液中滴加酚酞溶液 |
实验现象 | _____ | _____ |
实验结论 | 猜想4正确 | |
(反思评价)实验结束后,同学们经过交流与讨论后认为:探究反应后所得溶液的溶质成分时,不仅要考虑生成物,还要考虑反应物是否过量。
【答案】![]() 1 2 BaCl2溶液 产生白色沉淀 溶液变红
1 2 BaCl2溶液 产生白色沉淀 溶液变红
【解析】
(1)B中反应为二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为![]() 。
。
(2)[交流讨论]
一段时间后,关闭C,装置A中仍在反应.A中压强增大,液体会被压入到B装置中,氯化钙能与碳酸钠反应生成了碳酸钙沉淀,由于装置B出现的沉淀为CaCO3,会与盐酸反应,经讨论,所以猜想1一定不合理。
[实验探究]
实验1:由于氯化钙能与碳酸钠反应生成碳酸钙沉淀,所以向滤液中滴加碳酸钠溶液,无明显现象,则猜想2不正确;
实验2:由于碳酸钠显碱性,能与氯化钡反应,要检验碳酸钠、氢氧化钠的存在,应加入过量氯化钡溶液再加酚酞试液。现象为产生白色沉淀,且加入酚酞后溶液变红。

【题目】怎样确定某种溶液的酸、碱性?
实验原理:______________。
实验器材:小试管、小烧杯、6孔以上白色滴板(或代用品)、表面皿、pH试纸、试管架、试管刷。
除上述实验器材外,还应选择的仪器有(填字母)_____。

实验药品:2种家庭里常见的溶液、无色酚酞试液、紫色石蕊试液。
你所选用家庭里常见的溶液分别是____________ 和______________。
实验记录和
实验步骤 | 实验现象 | 实验结论 |
___________ | ___________ | ___________ |
【题目】NaHCO3在生产和生活中有许多重要用途,某学习小组对其性质进行了如下探究。物质的溶解度见下表。回答下列问题:
温度 | 10℃ | 20℃ |
NaHCO3的溶解度(g/100g水) | 8.1 | 9.6 |
Ca(HCO3)2的溶解度(g/100g水) | 16.6 |
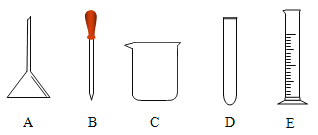
(1)在20℃时称取4gNaHCO3加入46mL蒸馏水(密度取值为lg/mL),充分搅拌制得澄清溶液。该实验可以达到探究NaHCO3____性的目的;实验中不需要的仪器是___(选填字母编号)。
(2)用pH计测得溶液的pH为8.2,说明溶液呈_______性。
(3)所配NaHCO3溶液的质量分数等于_____,降温到10℃时溶液___(填“是”或“不是”)饱和溶液
(4)取2mL所配NaHCO3溶液于试管中,滴加5%的CaCl2溶液,观察到气泡和白色沉淀,实验证明该气体是CO2。据此小组同学讨论认为:白色沉淀不可能是Ca(OH)2,其理由是_____,于是得出结论:白色沉淀是___。