题目内容
【题目】怎样确定某种溶液的酸、碱性?
实验原理:______________。
实验器材:小试管、小烧杯、6孔以上白色滴板(或代用品)、表面皿、pH试纸、试管架、试管刷。
除上述实验器材外,还应选择的仪器有(填字母)_____。

实验药品:2种家庭里常见的溶液、无色酚酞试液、紫色石蕊试液。
你所选用家庭里常见的溶液分别是____________ 和______________。
实验记录和
实验步骤 | 实验现象 | 实验结论 |
___________ | ___________ | ___________ |
【答案】pH>7,溶液呈碱性;pH<7,溶液呈酸性;pH=7,溶液呈中性;酸性溶液能使紫色的石蕊试液变红色,不能使无色酚酞变色;碱性溶液能使紫色石蕊试液变蓝色,能使无色酚酞试液变红色 B、E 食盐水 白醋 将pH试纸放到表面皿上,用玻璃棒蘸取待测溶液滴到pH试纸上,将试纸显示的颜色与标准比色卡对照 pH等于7(pH小于7) 该溶液是食盐水(该溶液是白醋)
【解析】
实验原理:pH>7,溶液呈碱性; pH<7,溶液呈酸性;pH=7,溶液呈中性;酸性溶液能使紫色的石蕊试液变红色,不能使无色酚酞变色;碱性溶液能使紫色石蕊试液变蓝色,能使无色酚酞试液变红色;故填:pH>7,溶液呈碱性;pH<7,溶液呈酸性;pH=7,溶液呈中性;酸性溶液能使紫色的石蕊试液变红色,不能使无色酚酞变色;碱性溶液能使紫色石蕊试液变蓝回色,能使无色酚酞试液变红色;
实验器材:滴加液体试剂需要用玻璃棒或胶头滴管;故填:B、E;
实验药品:选用家庭中常见的食盐水和白醋;故填:食盐水;白醋(其他合理答案也可);
实验记录与可用pH试纸来测定溶液的pH值,也可以选答择紫色的石蕊试液来鉴别,
实验步骤 | 实验现象 | 实验结论 |
将pH试纸放到表面皿上,用玻璃棒蘸取待测溶液滴到pH试纸上,将试纸显示的颜色与标准比色卡对照 | pH等于7(pH小于7) | 该溶液是食盐水(该溶液是白醋) |

【题目】某兴趣小组利用废旧电话线中的金属铜丝进行了如下一系列实验。

①如图所示,将铜丝分别放入盛有氯化锌溶液、稀硫酸、硝酸银溶液的试管中,观察到的现象是___________,发生反应的化学方程式为:___________。
②用细线吊着的长玻璃棒的两端分别绕有40 cm长的铜丝(如图所示),使玻璃棒保持平衡,用酒精灯加热玻璃棒左端2分钟后冷却,可以观察到的现象是__________,产生该现象的原因是__________。
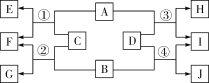
③为了研究金属铜生锈的条件,实验中将四段相同长度的铜丝分别按下图所示放置一个月,观察并记录现象如下:
E | F | G | H | |
实验装置 |
|
|
|
|
实验现象 | 铜丝不生锈 | 铜丝不生锈 | 铜丝不生锈 | 铜丝生锈 |
该实验设计体现的思想方法是_______________(选填:控制变量、对比与观察、定量分析、节能环保),结论:铜生锈是铜与 ______________作用的结果。
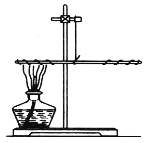
【题目】某化学实验小组的同学利用如图所示装置进行实验:
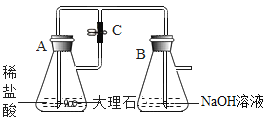
(1)A中反应开始时,弹簧夹C处于打开状态,B中反应的化学方程式为_____。
(2)一段时间后,关闭C,装置A中仍在反应,过一会儿,观察到装置B中出现白色沉淀。小组同学探究反应后装置B中的溶液的溶质成分。
(提出问题)反应后装置B中溶液的溶质成分是什么?
(猜想与假设)猜想1:NaCl、HCl 猜想2:NaCl、CaCl2
猜想3:NaCl、NaOH 猜想4:NaCl、NaOH、Na2CO3
(交流讨论)经讨论,大家一致认为猜想_____一定不合理。
(实验探究)将反应后装置B中所得混合物过滤,取少量滤液分别进行如下实验:
实验1:向滤液中滴加碳酸钠溶液,无明显现象,则猜想_____不正确。
实验2:请根据表中内容填写;
实验提供的药品有:酚酞溶液、稀盐酸、Ba(OH)2溶液、BaC12溶液。
实验操作 | 先向滤液中加入过量_____ | 再向滤液中滴加酚酞溶液 |
实验现象 | _____ | _____ |
实验结论 | 猜想4正确 | |
(反思评价)实验结束后,同学们经过交流与讨论后认为:探究反应后所得溶液的溶质成分时,不仅要考虑生成物,还要考虑反应物是否过量。