题目内容
【题目】现有铁和另一种金属组成的混合物,在5.6g该混合物中加入100g一定溶质质量分数的稀盐酸,两者恰好完全反应,产生H2的质量为m,下列说法不正确的是( )
A.若混合物为Fe、Zn,m小于0.2g
B.若混合物为Fe、Al,m大于0.2g
C.若混合物为Fe、Zn,m可能是0.1g,则该混合物中铁的质量分数为50%
D.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3%
【答案】C
【解析】
假设合金中铁的质量为5.6 g,稀盐酸的溶质质量分数为x,则
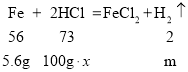
![]() ,
,![]()
m=0.2g,x=7.3%;
假设合金中锌的质量为5.6 g,则
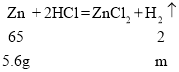
![]()
m=0.175g<0.2g;
假设合金中铝的质量为5.6 g,稀盐酸的溶质质量分数为y,则
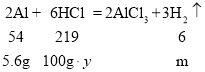
![]() ,
,![]()
m=0.62g>0.2 g,y=22.7%。
A、若混合物为Fe、Zn,m一定小于0.2g,说法正确;
B、若混合物为Fe、Al,m一定大于0.2g,说法正确;
C、若混合物为Fe、Zn,则0.175g <m<0.2g,m不可能是0.1g,说法错误;
D、当粉末为Fe、Al合金时,因相同质量的铝消耗稀盐酸的质量比铁消耗盐酸的质量大,而5.6 g全部是铁时,盐酸的溶质质量分数为7.3%,5.6 g全部是铝时,盐酸的溶质质量分数为22.7%,所以合金为为Fe-Al合金时,所需盐酸溶质质量分数一定大于7.3%,说法正确。
故选:C。

 黄冈冠军课课练系列答案
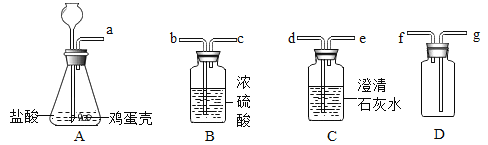
黄冈冠军课课练系列答案【题目】某化学实验小组的同学利用如图所示装置进行实验:
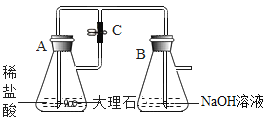
(1)A中反应开始时,弹簧夹C处于打开状态,B中反应的化学方程式为_____。
(2)一段时间后,关闭C,装置A中仍在反应,过一会儿,观察到装置B中出现白色沉淀。小组同学探究反应后装置B中的溶液的溶质成分。
(提出问题)反应后装置B中溶液的溶质成分是什么?
(猜想与假设)猜想1:NaCl、HCl 猜想2:NaCl、CaCl2
猜想3:NaCl、NaOH 猜想4:NaCl、NaOH、Na2CO3
(交流讨论)经讨论,大家一致认为猜想_____一定不合理。
(实验探究)将反应后装置B中所得混合物过滤,取少量滤液分别进行如下实验:
实验1:向滤液中滴加碳酸钠溶液,无明显现象,则猜想_____不正确。
实验2:请根据表中内容填写;
实验提供的药品有:酚酞溶液、稀盐酸、Ba(OH)2溶液、BaC12溶液。
实验操作 | 先向滤液中加入过量_____ | 再向滤液中滴加酚酞溶液 |
实验现象 | _____ | _____ |
实验结论 | 猜想4正确 | |
(反思评价)实验结束后,同学们经过交流与讨论后认为:探究反应后所得溶液的溶质成分时,不仅要考虑生成物,还要考虑反应物是否过量。
【题目】过氧化钠(![]() )是一种淡黄色固体,可用作呼吸面具中的供氧剂。某化学研究小组对过氧化钠的制备和实验室中过氧化钠药品的成分进行了如下探究。
)是一种淡黄色固体,可用作呼吸面具中的供氧剂。某化学研究小组对过氧化钠的制备和实验室中过氧化钠药品的成分进行了如下探究。
(查阅资料)①在点燃条件下, 钠在空气中燃烧生成纯度较高的![]()
②过氧化钠能和水以及二氧化碳发生如下化学反应:
![]() ;
;
![]() .
.
③金属钠遇水会发生剧烈反应生成![]()
Ⅰ.过氧化钠的制备:
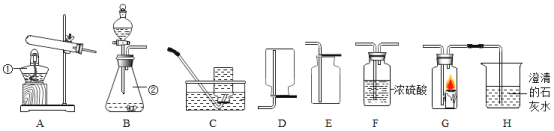
研究小组设计如图装置制备过氧化钠。
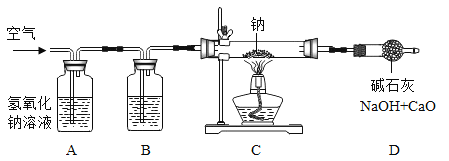
(1)装置B中的试剂是________。
(2)装置C中反应的化学方程式为________。
(3)装置D的作用是________。
Ⅱ.测定久置的过氧化钠样品的成分:
(定性检测)检测样品的成分
(4)请补充完成下列实验报告中的相关内容。
实验序号 | 实验步骤 | 实验现象 | 解释或结论 |
① | 取少量固体样品于试管中,加入适量的水 | 样品全部溶解,无气泡产生 | 样品中不含__; |
② | 取适量①中的溶液于试管中,加入过量的 | 有白色沉淀产生 | 化学方程式为_; |
③ | 待②充分静置后,向上层清液中滴入________; | _____; | 含有氢氧化钠 |
(定量检测)检测药品的组成。
(5)实验④:称取10g上述过氧化钠样品于试管中,加入足量的稀硫酸,将产生的气体全部鼓入到足量的澄清石灰水中,过滤、洗涤、干燥,得到碳酸钙固体5.00g。计算确定样品中氢氧化钠的质量分数_______(写出计算过程)
【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于氟元素的一条信息:_________。
(2) 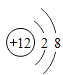 写出该结构简图的微粒符号_______。
写出该结构简图的微粒符号_______。
(3)第13号元素与第17号元素组成的化合物的化学式是 _______。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是____________(填字母序号)。
A Be和Mg
B C和Ne
C Al和Si
D F和Cl