题目内容
【题目】硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体和硫酸亚铁。试回答:
(l)实验室制取硫化氢的化学反应方程式为:_____。
(2)根据装置图回答下列问题:
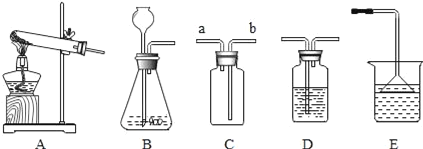
①制取硫化氢气体的发生装置可以选用_____。
②若用C装置收集硫化氢气体,进气口应为_____。
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是_____,现象是_____。
【答案】FeS+H2SO4═FeSO4+H2S↑ B b 紫色石蕊试液 紫色石蕊试液变红
【解析】
(1)硫化亚铁和稀硫酸反应产生硫酸亚铁和硫化氢气体的化学方程式为:FeS+H2SO4═FeSO4+H2S↑。
(2)①硫化亚铁和稀硫酸反应不需要加热,应该用B装置(固液发生装置)作为发生装置。
②若用C装置收集硫化氢气体,由于硫化氢的密度比空气大,应“长管进、短管出”进气口应为b。
③酸溶液能使紫色石蕊试液变成红色;因此,为证明硫化氢水溶液呈酸性,需要把气体通入紫色石蕊试液;D中所盛的试剂应该是紫色石蕊试液,现象是紫色石蕊试液变红。

【题目】金属和我们的关系很密切,它广泛地存在和应用于生产、生活等各个领域。
(1)下图为我们提供了金属铝、金属铁两种元素在元素周期表中的一些相关信息。
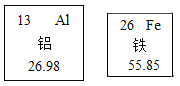
①铁原子核内的质子数为________________;
②铁元素相对原子质量为___________;
③铝的原子结构示意图为____________。
(2)乐乐兴趣小组在实验室进行实验探究:他们将两根完全相同的铝丝分别伸入到稀盐酸和稀硫酸中,观察发现铝丝产生气泡的快慢很是不同。
(提出问题)影响铝和酸反应速率的因素有哪些?
(大胆猜想)I.温度:
Ⅱ._______________:
Ⅲ.酸的种类。
(实验设计)为了验证猜想Ⅱ是否正确,乐乐兴趣小组的同学们进行了如下的实验探究。
实验步骤 | 实验观象 | 实验结论 |
打磨两根型号完全相同的铝丝,分别放入两支相同的试管中,再分别向其中倒入同体积、但不同浓度的稀盐酸 | ________________ | 酸的浓度越大,反应速率越快。 |
①上述反应的化学方程式为____________:
②使用铝丝前打磨的原因是___________。
③对铁质零件进行“发蓝”处理也是一种常用的防锈措施,因能在其表面形成致密氧化膜。若将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,便可以断定该铁质零件的“发蓝”处理效果不佳,原因是__________________。
(3)高铁的迅速发展对钢轨的需求量越来越大,质量要求越来越高。在工业上,经常用“铝热反应”原理来焊接钢轨,原理就是利用铝和氧化铁在高温条件下发生剧烈反应得到熔融的金属,其反应化学方程式为_____________。