题目内容
【题目】20℃时,将等质量的m、n两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,再升温到50℃时,现象如图甲,m、n两种固体的溶解度曲线如图乙。下列说法正确的是( )
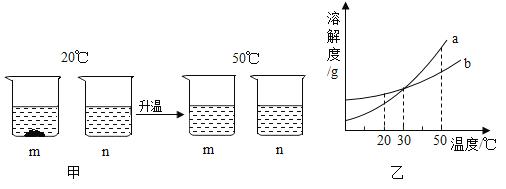
A.图乙中a表示m的溶解度曲线
B.图甲20℃溶液中溶质的质量分数m大于n
C.图甲50℃时的m、n溶液不一定是不饱和溶液
D.30℃时,a、b溶液溶质质量分数不相等
【答案】A
【解析】
A、根据图甲可知,20℃时n的溶解度大于m,则对应乙图,a表示固体m的溶解度曲线,故正确;
B、图甲20℃时,m没有全部溶解,则溶质的质量分数m小于n,故错误;
C、图甲50℃时,m、n全部溶解,且20℃时n已经完全溶解,则50℃时n一定为不饱和溶液,又因为50℃时m的溶解度大于n,故等质量的m、n完全溶解,m也一定是不饱和溶液,故错误;
D、30℃时,a、b相交于一点,表明溶解度在该温度下相等,等溶质等溶剂的溶液溶质质量分数相等,故错误。
故选A

【题目】酸、碱、盐在生产生活中具有广泛的用途。化学实验室中有失去标签的四瓶无色溶液:稀盐酸、氢氧化钙溶液、碳酸钠溶液、酚酞试液,现将其任意编号为A、B、C、D.然后两两组合进行实验,其中部分现象如下表,请回答:
实验 | A+B | A+C | B+C | B+D |
现象 | 溶液变红 | 溶液变红 | 产生沉淀 | 产生气体 |
(1)配酞试液是____________(填编号);
(2)B与C反应的化学方程式为____________________。
(3)写出D的一种用途:____________________。
【题目】化学课上老师演示在氢氧化钠溶液中滴加稀盐酸实验时,出现了有气泡产生的现象,同学们计划对产生该现象的原因进行探究。
(提出问题)产生的气体成分是什么?
(设计实验)将生成的气体通入澄清的石灰水,石灰水变浑浊。
(分析与讨论)①生成的气体是_____。
②氢氧化钠已变质,变质的原因用化学方程式表示为_____。
(进一步探究)氢氧化钠溶液变质的程度如何?
(实验方案)
方案1:取少量氢氧化钠溶液的样品于一洁净试管中,先滴加酚酞溶液,酚酞变红色,再滴加氯化钙溶液,出现白色沉淀。
方案2:取少量氢氧化钠溶液的样品于一洁净试管中,先滴加澄清石灰水,出现白色沉淀,静置,再在上层溶液中滴加酚酞溶液,酚酞变红色。
(分析与讨论)同学们认为以上两个方案都不正确。
方案1不正确的原因是_____。
方案2不正确的原因是_____。
经过讨论同学设计了以下方案,得到了合理的结论。
实验步骤 | 实验现象 | 实验结论 |
(1)取少量氢氧化钠溶液的样品于一洁净试管中,先滴加过量的氯化钙溶液,观察现象。 | _____ | 氢氧化钠部分变质 |
(2)再向其中滴几滴酚酞溶液。 | 酚酞变红色。 |
实验中滴加过量氯化钙溶液的目的是_____。
在氢氧化钠溶液中滴加稀盐酸,溶液温度与滴加稀盐酸质量之间的变化关系如图所示:
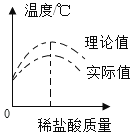
(1)实验中发现稀盐酸质量为m1时,测得的溶液温度最高,从能量的角度分析,氢氧化钠与稀盐酸的反应是_____反应;从反应进行的程度分析,温度达到最大值时,表示_____。随后溶液温度降低的原因是_____。
(2)实验数据分析可知测得的实际值低于理论值,请写出一点导致这种差异出现的原因_____。