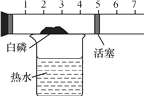
题目内容
【题目】清理实验室时,发现如下三个内壁都有白色固体的细口瓶,曾经装过标签标示的溶液。现要清洗这些细口瓶,请回答问题。

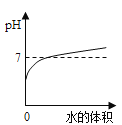
(1)只用水不能清洗干净的细口瓶是____(填字母),形成这种固体的化学反应的方程式为____。
(2)最后用稀盐酸和水将三个细口瓶洗净,洗后液体倒入一个干净的容器中,得到澄清无色溶液,其中一定含有的溶质是______。
【答案】B Ca(OH)2+CO2=CaCO3↓+H2O NaCl CaCl2
【解析】
(1)由于氢氧化钙能与二氧化碳反应生成碳酸钙沉淀和水,碳酸钙不溶于水,故不能用清水洗净的细口瓶是B。
(2)盐酸能与A中的物质反应生成氯化钠,能与B中的物质反应生成氯化钙,故得到的澄清溶液中一定含有氯化钠和氯化钙。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】小组同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
【提出问题】金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b. 可能与反应时的温度有关。
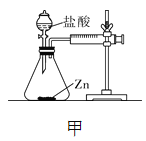
【设计并实验】小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的锌片进行如下实验。
实验编号 | 盐酸的质量分数(均取20 mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
【讨论】(1)写出锌与稀盐酸反应的化学方程式__________。
(2)实验时,需将金属片打磨,其目的是__________。
(3)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是______________。
【分析数据、得出结论】
(4)实验中记录的数据可能是_____________。
(5)对比实验________可知温度对金属与酸反应的速率的影响。
(6)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③。根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于哪两次实验所记录的数据之间?________________________。
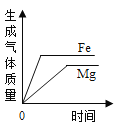
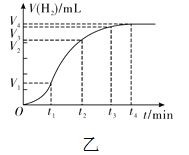
【拓展】进行锌与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳锌与稀盐酸反应速率的变化规律______________,结合上述探究解释曲线变化的原因 ________________________________。
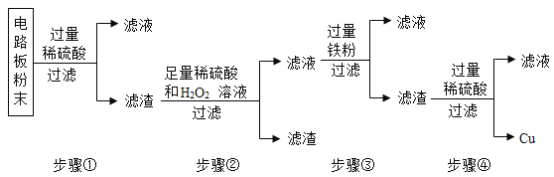
【题目】某化学研究性学习小组在实验室进行了化学实验,向一盛有锌和铜混合物的烧杯中加入一定量的稀硫酸,充分反应后,观察到烧杯中有固体剩余,对反应后所得溶液中溶质的成分进行探究。
(1)写出上述烧杯中发生反应的化学方程式______。
(2)对反应后所得溶液中溶质的成分进行猜想,请你再补充一种猜想。
(猜想)猜想一:溶质为硫酸锌;
猜想二:溶质为硫酸铜和硫酸锌;
猜想三:溶质为______。
(3)(讨论)你认为猜想______不合理,理由是______。
(4)(实验)若猜想三正确,完成下列实验方案证明你的猜想。
实验步骤 |
| 实验结论 |
用玻璃棒蘸取少量待测液滴到 | _______ | 猜想三正确 |
(5)(应用)如果猜想三正确,把该废液倒入铁质下水管道可能造成危害,为消除此废液可能带来的危害,一般会在废液中加入适量的熟石灰,请写出此反应的化学方程式:_______。