题目内容
【题目】小组同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
【提出问题】金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b. 可能与反应时的温度有关。
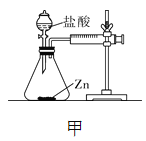
【设计并实验】小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的锌片进行如下实验。
实验编号 | 盐酸的质量分数(均取20 mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
【讨论】(1)写出锌与稀盐酸反应的化学方程式__________。
(2)实验时,需将金属片打磨,其目的是__________。
(3)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是______________。
【分析数据、得出结论】
(4)实验中记录的数据可能是_____________。
(5)对比实验________可知温度对金属与酸反应的速率的影响。
(6)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③。根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于哪两次实验所记录的数据之间?________________________。
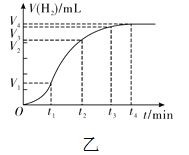
【拓展】进行锌与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳锌与稀盐酸反应速率的变化规律______________,结合上述探究解释曲线变化的原因 ________________________________。
【答案】 Zn+2HCl=ZnCl2+H2↑ 除去金属表面的氧化膜和污物 检查装置的气密性 相同时间内注射器中收集到气体的体积(或注射器中收集相同体积气体所用的时间) ①③(或②④) 实验②与实验④ 开始由慢变快,一段时间后,由快变慢 锌与稀盐酸反应放出热量使温度升高,开始时温度升高对反应速率的影响较盐酸浓度变小对反应速率影响更大,一段时间后,盐酸浓度减小对反应速率的影响较温度升高对反应速率的影响更大
【解析】(1)锌与稀盐酸反应生成氯化锌和氢气;
(2) 金属在空气中其表面能生成一层氧化膜,开始氧化膜先与酸接触反应生成盐和水几乎不能产生氢气,据此分析;
(3)根据检查装置气密性分析解答;
(4)根据对比实验分析解答;
(5)根据对比实验分析解答;
(6)根据对比实验分析解答;
【拓展】根据稀盐酸和锌反应的速率变化图像和影响因素分析解答。
解:(1)锌与稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;
(2)金属在空气中其表面能生成一层氧化膜,氧化膜会阻止金属与药品的接触,所以要先除去氧化膜和污物;
(3)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是:检查装置的气密性;
(4)实验中记录的数据可能是相同时间内注射器中收集到气体的体积(或注射器中收集相同体积气体所用的时间) ;
(5)对比实验①③(或②④)可知温度对金属与酸反应的速率的影响;
(6) 实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③。根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于实验②与实验④所记录的数据之间;
【拓展】进行锌与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳锌与稀盐酸反应速率的变化规律:开始由慢变快,一段时间后,由快变慢,结合上述探究解释曲线变化的原因是:锌与稀盐酸反应放出热量使温度升高,开始时温度升高对反应速率的影响较盐酸浓度变小对反应速率影响更大,一段时间后,盐酸浓度减小对反应速率的影响较温度升高对反应速率的影响更大。

【题目】区分下列各组物质的两种方法都正确的是( )
需区分物质 | 方法一 | 方法二 | |
A | 空气和氧气 | 用带火星木条检验 | 闻气味 |
B | 双氧水和水 | 观察颜色 | 加二氧化锰 |
C | 铜丝和铁丝 | 用磁铁吸引 | 观察颜色 |
D | 二氧化碳和氮气 | 澄清石灰水 | 紫色的石蕊试液 |
A. A B. B C. C D. D