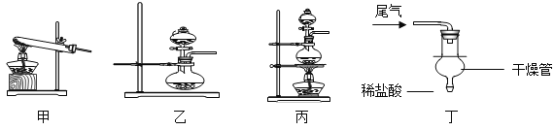
题目内容
【题目】铜与硫酸在常温下不发生化学反应,在加热条件下是否可以发生化学反应呢?化学学习小组同学开展以下探究活动,请你参与。
(探究活动一)
[实验1] 取某溶质质量分数硫酸溶液于试管中,插入足量的细铜丝加热至沸腾,无明显现象;继续加热一段时间,闻到刺激性气味,溶液显蓝色。
[老师提示]:刺激性气味的气体可能是二氧化硫。
[查阅资料]①二氧化硫可以使品红溶液褪色; ②二氧化硫与二氧化碳部分化学性质相似,能与水反应,也能与氢氧化钠溶液反应。
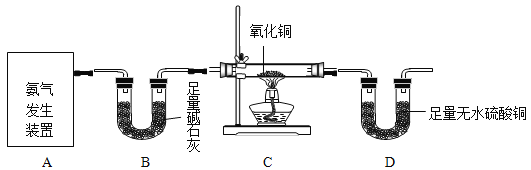
[实验2] 采用如图装置进行实验,验证“实验1” 中产生的气体。(图上硫酸溶液前加上80%)
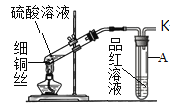
(1)观察到:A试管______________,说明在加热条件下,铜与浓硫酸反应产生了二氧化硫气体。写出该反应的化学方程式:_________________ 。
(探究活动二)
同学们为探究实验1中“加热初始不反应,一段时间后发生反应”的原因,再进行如下实验。
[实验3] 在“实验2”的装置中,把A试管中的品红溶液换成紫色石蕊试液,取几种不同溶质质量分数的硫酸溶液各2mL,分别与质量相同、形状相同的细铜丝进行试验,(每次实验都加热至沸腾的时候),实验结果如下表。
硫酸溶质质量分数 | 98% | 80% | 68% | 44% | 38% | 32% | 20% |
石蕊试液的颜色 | 红色 | 红色 | 红色 | 红色 | 紫色 | 紫色 | 紫色 |
[分析讨论]
(3)上述实验结果表明:在加热至沸腾的条件下,溶质质量分数至少不小于____的硫酸溶液都可以与铜反应。
(4)要获得比实验3的结果即在加热到沸腾时,能与铜反应的硫酸溶液的溶质质量分数更精确的数据范围,请你设计进一步探究的实验方案:_____________ 。
(5)“实验1”中加热至沸腾一段时间后铜才能与硫酸反应的原因是______________。
[反思与评价]
(6)二氧化硫为有毒气体,为防止其污染空气,在“实验2”中,需对实验装置中的导管口K处排出的尾气进行处理,方法是______。
【答案】品红溶液褪色 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 44% 选择硫酸的质量分数在38%~44%之间的硫酸和铜混合加热至沸腾,观察石蕊试液是否变红色,从而确定能与铜反应的硫酸溶液的溶质质量分数更精确的数据范围 加热使溶液中的水不断蒸发,硫酸浓度逐渐増大,当达到一定浓度时,硫酸与铜发生反应 把尾气通入氢氧化钠溶液中,或收集起来进行再利用
CuSO4+SO2↑+2H2O 44% 选择硫酸的质量分数在38%~44%之间的硫酸和铜混合加热至沸腾,观察石蕊试液是否变红色,从而确定能与铜反应的硫酸溶液的溶质质量分数更精确的数据范围 加热使溶液中的水不断蒸发,硫酸浓度逐渐増大,当达到一定浓度时,硫酸与铜发生反应 把尾气通入氢氧化钠溶液中,或收集起来进行再利用
【解析】
铜和浓硫酸反应生成硫酸铜、二氧化硫和水;二氧化硫和氢氧化钠反应生成亚硫酸
钠和水,和水反应生成亚硫酸,亚硫酸显酸性,能使石蕊试液变红色。
(1)A试管品红溶液褪色,说明在加热条件下,铜与浓硫酸反应产生了二氧化硫气体。铜和浓硫酸反应生成硫酸铜、水和二氧化硫,该反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)上述实验结果表明:在加热至沸腾的条件下,溶质质量分数至少不小于44%时,石蕊试液都变红色,说明都生成了二氧化硫气体,即铜都能和硫酸反应。
(3)要获得比实验3的结果即在加热到沸腾时,能与铜反应的硫酸溶液的溶质质量分数更精确的数据范围,实验方案:选择硫酸的质量分数在38%~44%之间的硫酸分别和铜混合加热至沸腾,观察石蕊试液是否变红色,从而确定能与铜反应的硫酸溶液的溶质质量分数更精确的数据范围。
(4)“实验1”中加热至沸腾一段时间后铜オ能与硫酸反应的原因是:加热使溶液中的水不断蒸发,硫酸浓度逐渐増大,当达到一定浓度时,硫酸与铜发生反应。
(5)二氧化硫为有毒气体,为防止其污染空气,在“实验2”中,需对实验装置中的导管口K处排出的尾气进行处理,方法是:把尾气通入氢氧化钠溶液中,或收集起来进行再利用。

【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到酚酞溶液不变色。
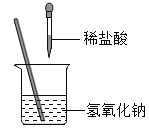
请写出该中和反应方程式:___________________________________________________。
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学:__________________________________________________________。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是:_______________________。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH________(填“>”“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
【题目】空气中氧气含量测定的再认识。
(实验回顾)如图是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
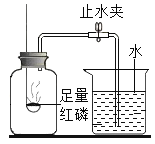
(1) 写出红磷燃烧的化学方程式_____。
(2) 实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内_____减小,烧杯中水倒吸到集气瓶。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
(实验改进)
Ⅰ. 根据铁在空气中生镑的原理设计下图实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。
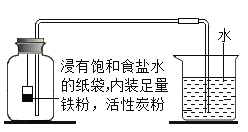
Ⅱ.测得实验数据如表
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(交流表达)
(3) 根据表4数据计算,改进实验后测得的空气中氧气的体积分数是_____(计算结果精确到0.1%)。
(4) 从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是:
①_____;②_____;