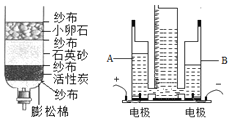
题目内容
【题目】根据下列装置图,回答有关问题:

(1)写出装置图中标号仪器的名称:a____。
(2)实验室用高锰酸钾制取氧气,其发生装置可选择____(填字母),反应的化学方程式是____。可用E装置收集氧气的原因是____。
(3)实验室通常用装置B与____(填字母)相连制取二氧化碳,该反应化学方程式是____。用右图所示装置制二氧化碳,有“随开随用、随关随停”的效果。在反应的过程中,若关闭导管上的活塞K,反应停止,其原理是____。

(4)用纯净的二氧化碳气体按右图装置进行实验。观察到的主要现象是:甲中____、乙中澄清石灰水变浑浊。乙中发生反应的化学方程式为____。

【答案】长颈漏斗 A 2KMnO4![]() K2MnO4+MnO2+O2↑ 氧气不易溶于水,且不与水反应 C CaCO3+2HCl=CaCl2+H2O+CO2↑ 关闭活塞K,干燥管内压强增大,把液体压回烧杯,固体与液体完全分离,反应停止 紫色石蕊溶液变红 CO2+Ca(OH)2=CaCO3↓+H2O
K2MnO4+MnO2+O2↑ 氧气不易溶于水,且不与水反应 C CaCO3+2HCl=CaCl2+H2O+CO2↑ 关闭活塞K,干燥管内压强增大,把液体压回烧杯,固体与液体完全分离,反应停止 紫色石蕊溶液变红 CO2+Ca(OH)2=CaCO3↓+H2O
(1)长颈漏斗方便加液体药品;
(2)制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集。
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热。二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集。用图G所示装置制二氧化碳,有“随开随用、随关随停”的效果。在反应的过程中,若关闭导管上的活塞K,反应停止,其原理是:关闭活塞K,干燥管内压强增大,把液体压回烧杯,固体与液体完全分离,反应停止;
(4)用纯净的二氧化碳气体按图H装置进行实验,观察到的主要现象是:甲中紫色石蕊溶液变红、乙中澄清石灰水变浑浊。
【解析】
(1)据图可知仪器a是长颈漏斗;
(2)如果用高锰酸钾制氧气就需要加热,可选装置A;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,反应的化学方程式是:2KMnO4![]() K2MnO4+MnO2+O2↑;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;
K2MnO4+MnO2+O2↑;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,可选发生装置B,二氧化碳能溶于水且密度比空气大,可用向上排空气法收集,可选装置C;碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;因此不需要加热;在反应的过程中,若关闭导管上的活塞K,反应停止,其原理是:关闭活塞K,干燥管内压强增大,把液体压回烧杯,固体与液体完全分离,反应停止;
(4)用纯净的二氧化碳气体按图H装置进行实验,观察到的主要现象是:甲中紫色石蕊溶液变红、乙中澄清石灰水变浑浊,因为二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;反应的化学方程式是: CO2+Ca(OH)2=CaCO3↓+H2O。

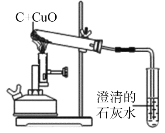
【题目】碳还原氧化铜的实验如右图所示。写出该反应的化学方程式____。
(提出问题)碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
(作出猜想)猜想①:CO
猜想②:CO2
想③:____________。
(设计方案)实验装置如图(浓硫酸具有吸水作用)。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
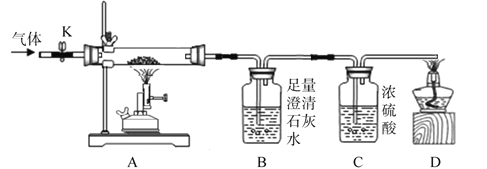
方案一:从定性观察角度判断
(1)实验时A处的现象是____________。
(2)若猜想①成立,B、D处的现象是_____________(填序号)。
a.B中变浑浊,D处能点燃 b.B中变浑浊,D处不能点燃
c.B中无明显实验现象,D处能点燃 d.B中无明显实验现象,D处不能点燃
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B+C(广口瓶+混合液) | m3 | m4 |
(3)若猜想②成立,则理论上(m4-m3)__(m1-m2)(选填“<”、“>”或“=”)。
(4)若猜想③成立且CuO全部转化成Cu,则参加反应的碳的质量m的取值范围是____。
(交流反思)实验开始前缓缓通入氮气的目的是____。