题目内容
【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到酚酞溶液不变色。
请写出该中和反应方程式:___________________________________________________。
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学:__________________________________________________________。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是:_______________________。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH________(填“>”“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
【答案】NaOH+HCl=NaCl+H2O 猜想三:两种物质反应后稀盐酸过量,溶液显酸性 理由是:若氢氧化钠有剩余,则反应后滴入无色酚酞溶液就不会出现无色的现象,而溶液会变红才对. < 从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加1-2滴紫色石蕊溶液,振荡 溶液变红 猜想三成立 从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加碳酸钠溶液 有气泡产生 猜想三成立
【解析】
反应物是氢氧化钠和盐酸,生成物是氯化钠和水,所以方程式是:NaOH+HCl=NaCl+H2O;
(1)在猜想时要考虑两种物质恰好完全反应,反应物过量问题,氢氧化钠过量或盐酸过量,所以猜想三是:两种物质反应后稀盐酸过量,溶液显酸性;由于溶液中滴入酚酞试液没有变色,碱过量时溶液应该变为红色,所以猜想二错误;
(2)①猜想一不正确,说明不是恰好反应,只能是盐酸过量,显酸性,PH值<7;
②证明溶液显酸性,可以取待测液加入紫色石蕊试液,如果变为红色,说明显酸性,盐酸过量,所以从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加1-2滴紫色石蕊溶液,振荡,变为红色即可;
(3)由于盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,所以从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加碳酸钠溶液,有气泡产生,说明盐酸过量。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】某实验小组同学对铁粉和氧化铜的混合物与足量的稀硫酸混合后,体系中各反应的先后顺序进行研究。
氧化铜与稀硫酸反应的化学方程式为________________。
(进行实验)以下实验中所用硫酸都是过量的。
实验1:将铁粉和氧化铜的混合物与60mL、10%稀硫酸混合,实验记录如下。
序号 | 铁粉/g | 氧化铜/g | 实验现象 |
1-1 | 0.56 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈蓝色 |
1-2 | 1.12 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
1-3 | 1.68 | 1.6 | 立即出现红色固体,待红色固体不再增加后产生大量气泡,充分反应后溶液呈浅绿色 |
实验2:将1.12g铁粉和1.6g氧化铜的混合物与30mL不同浓度的硫酸混合,实验记录如下。
序号 | 硫酸浓度/% | 实验现象 |
2-1 | 20 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
2-2 | 30 | 立即出现红色固体,瞬间产生大量气泡,充分反应后溶液呈浅蓝色 |
2-3 | 50 | 立即出现红色固体,瞬间产生大量气泡,反应过程中生成红色固体的同时持续产生细小气泡,充分反应后溶液呈浅蓝色 |
(解释与结论)
(1)浅绿色溶液中一定含有的溶质是H2SO4、____。
(2)实验中出现红色固体反应的化学方程式为_________;
(3)依据实验1推测,在稀硫酸浓度为10%,且硫酸足量的条件下,铁粉、氧化铜与稀硫酸反应的先后顺序为________。
(4)对比分析实验1-2与1-3,解释实验1-2没有产生气泡的原因______。
(5)在实验1-3中,产生氢气的质量最多为____ g。
6)根据实验2判断,下列说法不正确的是____(填字母序号)。
A 硫酸浓度为20%,CuO先于Fe与硫酸反应
B 硫酸浓度为40%,Fe将先于CuO与硫酸反应
C 硫酸浓度为50%,Fe与CuSO4反应的同时也与硫酸反应
【题目】以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
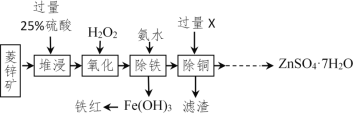
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
a | 30 | 2 | 91.5 |
b | 30 | 2.5 | 93.3 |
c | 40 | 2.5 | 95.1 |
d | 40 | 3.1 | Y |
e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。
【题目】某兴趣同学在实验室的试剂柜中发现一瓶失去标签的无色溶液,可能是硫酸、 硝酸铁、氯化钠、氢氧化钡中的其中一种。为了确定该无色溶液并预测其化学性质, 进行下列实验:
(1)根据上述信息判断,该溶液一定不是________________溶液。(填化学式,下同)
(2)取样,用 pH 试纸测定该溶液呈碱性,该溶液一定是________________溶液。
(3)请预测其化学性质,说出预测依据,并设计实验验证。 限用试剂:酚酞溶液、铁、盐酸、氧化铜、硫酸钾溶液、硝酸镁溶液、硝酸铜溶液。
预测 | 预测的依据 | 检验预测的实验操作与预测现象 |
(1)能与含有 | 氢氧化钡溶液能解离 出 | 取少量待测溶液于试管中,滴入________________溶液,如果观察到________________则预测成立。 |
(2)能与_______________(填物质类别)反应 | _______________ | 取 少 量 待 测 溶 液 于 试 管 中 ,__________ , 如果观察到 _________ _, 则预测成立。 |