题目内容
【题目】某校化学研究性学习小组的同学为了探究氨气与氧化铜反应的产物,设计了如下实验装置图:
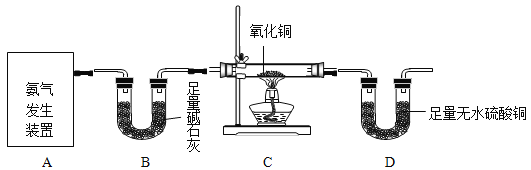
已知:①碱石灰主要成分为氢氧化钠和氧化钙的混合物
②无水硫酸铜遇水变蓝色
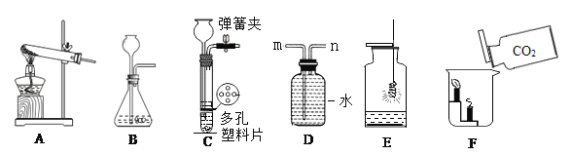
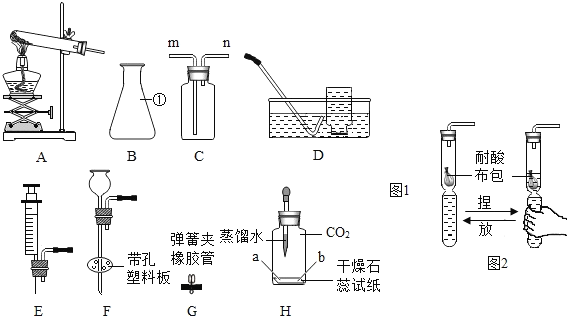
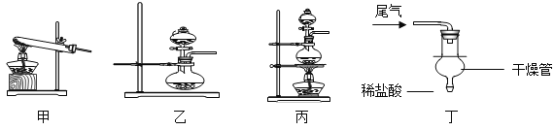
(1)实验室常用加热氯化铵和氢氧化钙的固体混合物来制取氨气,该反应的化学方程式为_________。实验室还可通过向生石灰中滴加浓氨水的方法快速制取少量氨气,则可选择______________(填下图装置编号)作发生装置。检验氨气常用湿润的___________石蕊试纸;
(2)实验操作中,应___________(填字母序号);
a 先通氨气,后点燃酒精灯 b 先点燃酒精灯,后通氨气
(3)装置C处现象为________________,则说明可能生成铜;
(4)装置________________(填装置字母序号)和装置D的组合证明有水生成;
(5)实验中还生成了一种气体单质,该小组同学依据____________________,猜想该单质为氮气;
(6)若装置C连同固体质量减轻4.8g,则装置D增加的质量为_____________g。实验测得装置D增加的质量大于理论值,可能的原因是__________________________;
(7)氨气也是污染物,在D装置后可连接丁装置,以吸收尾气中未参加反应的氨气。干燥管的作用是___________(填序号);
①防止氨气逸出 ②防止液体倒吸 ③防止盐酸挥发
【答案】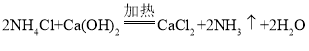 乙 红色 a 黑色固体变成红色。 B 质量守恒定律 5.4g 吸收空气中的水蒸气 ②
乙 红色 a 黑色固体变成红色。 B 质量守恒定律 5.4g 吸收空气中的水蒸气 ②
【解析】
生石灰固体和浓氨水溶液在常温下反应生成氨气,应选用固液不加热型装置,可用红色石蕊试纸检验碱性气体;没有空气中成分参加的化学反应应先排出装置内的空气;氧化铜为黑色,单质铜为红色;碱石灰可除去水分,无水硫酸铜可检验水的存在。
(1)氯化铵和氢氧化钙的反应属于复分解反应,生成氯化钙、氨气和水;生石灰固体和浓氨水溶液在常温下反应生成氨气,化学方程式为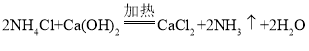 。应选用固液不加热型装置,因此选乙;红色石蕊试纸遇碱变蓝,可检验呈碱性的氨气。
。应选用固液不加热型装置,因此选乙;红色石蕊试纸遇碱变蓝,可检验呈碱性的氨气。
(2)为排出装置内的空气,防止生成的单质铜被氧化,应先通一段时间氨气,再点燃酒精灯,故选a。
(3)氨气还原氧化铜,使黑色氧化铜将被还原成红色的单质铜,故现象为黑色固体变成红色。
(4)用装置B除去氨气中含有的水份后,当装置D中白色的无水硫酸铜变成蓝色,证明反应生成了水,故选B。
(5)氨气中含有氮元素,依据质量守恒定律,可猜想有氮气生成,故依据为质量守恒定律。
(6)装置C中减少的质量为氧化铜中氧元素的质量,根据氧元素的质量可求出生成的水的质量,即为装置D中增加的质量为![]() ;由于D装置直接与空气想通,则可能吸收空气中的水蒸气。
;由于D装置直接与空气想通,则可能吸收空气中的水蒸气。
(7)利用球型干燥管中间部分体积较大的特点可防止氨气被稀盐酸吸收时,液体倒吸入D装置中,故选②。

 阅读快车系列答案
阅读快车系列答案【题目】铜与硫酸在常温下不发生化学反应,在加热条件下是否可以发生化学反应呢?化学学习小组同学开展以下探究活动,请你参与。
(探究活动一)
[实验1] 取某溶质质量分数硫酸溶液于试管中,插入足量的细铜丝加热至沸腾,无明显现象;继续加热一段时间,闻到刺激性气味,溶液显蓝色。
[老师提示]:刺激性气味的气体可能是二氧化硫。
[查阅资料]①二氧化硫可以使品红溶液褪色; ②二氧化硫与二氧化碳部分化学性质相似,能与水反应,也能与氢氧化钠溶液反应。
[实验2] 采用如图装置进行实验,验证“实验1” 中产生的气体。(图上硫酸溶液前加上80%)
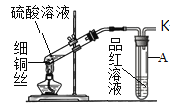
(1)观察到:A试管______________,说明在加热条件下,铜与浓硫酸反应产生了二氧化硫气体。写出该反应的化学方程式:_________________ 。
(探究活动二)
同学们为探究实验1中“加热初始不反应,一段时间后发生反应”的原因,再进行如下实验。
[实验3] 在“实验2”的装置中,把A试管中的品红溶液换成紫色石蕊试液,取几种不同溶质质量分数的硫酸溶液各2mL,分别与质量相同、形状相同的细铜丝进行试验,(每次实验都加热至沸腾的时候),实验结果如下表。
硫酸溶质质量分数 | 98% | 80% | 68% | 44% | 38% | 32% | 20% |
石蕊试液的颜色 | 红色 | 红色 | 红色 | 红色 | 紫色 | 紫色 | 紫色 |
[分析讨论]
(3)上述实验结果表明:在加热至沸腾的条件下,溶质质量分数至少不小于____的硫酸溶液都可以与铜反应。
(4)要获得比实验3的结果即在加热到沸腾时,能与铜反应的硫酸溶液的溶质质量分数更精确的数据范围,请你设计进一步探究的实验方案:_____________ 。
(5)“实验1”中加热至沸腾一段时间后铜才能与硫酸反应的原因是______________。
[反思与评价]
(6)二氧化硫为有毒气体,为防止其污染空气,在“实验2”中,需对实验装置中的导管口K处排出的尾气进行处理,方法是______。