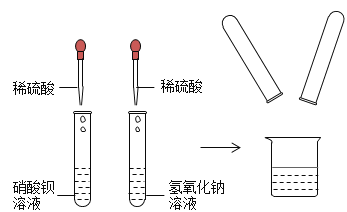
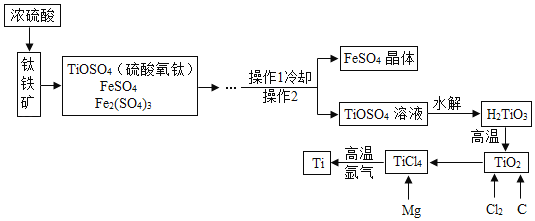
题目内容
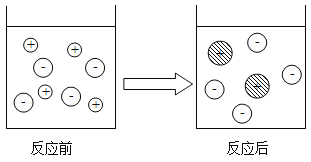
【题目】下图是过氧化氢在一定条件下发生分解反应的微观模拟图,请回答下列问题:
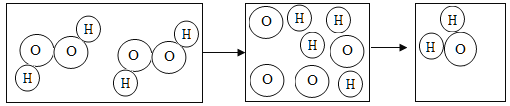
(1)在C图中将相关粒子图形补充完整_____(用“![]() ”表示氢原子,用“
”表示氢原子,用“![]() ”表示氧原子);
”表示氧原子);
(2)此化学变化中,B到C过程的微观实质是_____;
(3)写出与一个水分子电子数相同但质子数多两个的粒子的符号_____;
【答案】补充一个水分子和一个氧分子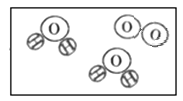 每两个氢原子和一个氧原子结合成一个水分子,每两个氧原子结合成一个氧分子 Mg2+
每两个氢原子和一个氧原子结合成一个水分子,每两个氧原子结合成一个氧分子 Mg2+
【解析】
(1)由质量守恒定律,反应前后原子的种类及数目不变,可知C图中应补充一个氧分子和一个水分子。
(2)在化学反应过程中分子被破坏成原子,而原子又重新组成新的分子,B到C过程的微观实质是:每两个氢原子和一个氧原子结合成一个水分子,每两个氧原子结合成一个氧分子。
(3)一个氢原子含有1个质子1个电子,一个氧原子含有8个质子8个电子,因此一个水分子含有10个质子10个电子,与一个水分子电子数相同但质子数多两个的粒子应该含有10个电子、12个质子,根据元素周期表可知,含有12个质子的元素是镁,10电子的粒子是镁离子,粒子符号是Mg2+。

练习册系列答案
相关题目