题目内容
【题目】盐酸是一种重要的化工产品,醋酸(CH3COOH)是一种常见的生活调味品,它们也都是实验室中常用的化学试剂。
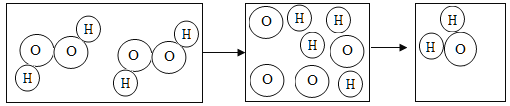
(1)增大压强,HCl由气态变为液态,从微观的角度分析该变化过程中改变的是_____。
(2)在盐酸中加入过量的铁粉充分反应。
①可以看到的现象是_____。
②如图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号):
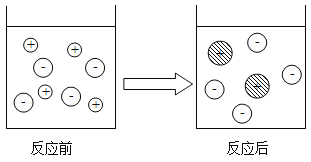
![]() _____,
_____,![]() _____。
_____。
③下列金属中能与盐酸发生类似反应的是_____(填选项)。
A Cu B Mg C Au D Ag
(3)醋酸与氢氧化钠溶液反应生成醋酸钠和水,化学方程式为:CH3COOH+NaOH=CH3COONa+H2O。醋酸与盐酸一样,能与活泼金属反应生成氢气。请写出醋酸与金属锌反应的化学方程式为_____。
【答案】氯化氢分子之间的间隔或空隙变小 有气泡产生,溶液由无色变成浅绿色 ![]()
![]() B
B ![]()
【解析】
(1)增大压强,HCl由气态变为液态,没有新物质生成,属于物理变化,从微观的角度可知该变化过程中分子本身没有发生变化,发生改变的是分子时间的间隔,压强增大,氯化氢分子之间的间隔或空隙变小。
(2)在盐酸中加入过量的铁粉充分反应,铁与稀盐酸反应生成氯化亚铁和氢气,则有:
①可以看到的现象是产生气泡,溶液由无色变成浅绿色。
②如图表示该反应前后溶液中存在的主要离子,如图所示反应前为稀盐酸,氯化氢的水溶液,氯化氢在水中解离成氢离子和氯离子,反应后为氯化亚铁的溶液,氯化亚铁在水中解离成亚铁离子和氯离子,则图中的![]() 表示的离子为
表示的离子为
![]() ,
,![]() 表示的离子为
表示的离子为
![]() 。
。
③A、根据金属活动性顺序可知Cu位于金属活动性顺序表氢元素之后,不能与稀盐酸反应,A选项不正确,不符合题意;
B、根据金属活动性顺序可知Mg位于金属活动性顺序表氢元素之前,能与稀盐酸反应生成氯化镁和氢气,B选项正确,符合题意;
C、根据金属活动性顺序可知Au位于金属活动性顺序表氢元素之后,不能与稀盐酸反应,C选项不正确,不符合题意;
D、根据金属活动性顺序可知Ag位于金属活动性顺序表氢元素之后,不能与稀盐酸反应,D选项不正确,不符合题意。故选B。
(3)由题意可知醋酸与盐酸一样,能与活泼金属反应生成氢气,醋酸与金属锌反应生成醋酸锌和氢气,反应的化学方程式为![]() 。
。

【题目】食品工业中碘化钾(KI)可用作营养增补剂。碘化钾是白色固体,在空气中久置会“泛黄”变质。某实验小组对碘化钾变质后的成分及变质的条件进行探究。
I.探究变质后的固体成分
(查阅资料)淀粉溶液遇碘(I2)变蓝。
(进行实验)
实验 1
编号 | ① | ② |
操作及现象 | 加热变质后的 KI 固体,黄色消失, 产生的紫色蒸气使淀粉溶液变蓝。 | 向变质后的 KI 固体中滴加稀盐酸, 产生的气体使澄清石灰水变浑浊。 |
II.探究变质的条件
(猜想与假设)常温下,KI 固体“泛黄”变质可能与 O2、CO2 和水蒸气有关。
(进行实验)
实验 2:利用下图装置和表中所列物质分别进行实验,放置相同时间,现象如下表。
装置 | 编号 | ① | ② | ③ | ④ |
| 试管中的物质 | O2 和 H2O | O2 和 CO2 | H2O 和 CO2 | O2、CO2 和H2O |
固体颜色 | 无明显变化 | 无明显变化 | 无明显变化 | 固体泛黄 |
(解释与结论)
(1)实验 1 中石灰水变浑浊的原因是_________(用化学方程式表示)。
(2)由实验 1 中现象推知,“泛黄”变质后的固体中含有的物质是________。
(3)由实验 2 得出“KI 变质一定与 O2 有关”的结论,依据的两个实验是________(填编号)。
(4)由实验 2 推知,KI“泛黄”变质的条件是_________。
III.依据初步结论,深入探究变质的条件
实验 3:分别取相同浓度的 KI 溶液进行实验,在空气中放置相同时间,现象如下表。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
溶液颜色 | 无色 | 浅黄色 | |||
(5)实验 3 中,观察到③~⑤溶液颜色依次加深,推测其原因是________。
(6)由实验 3 推知,KI 固体久置“泛黄”变质过程中,CO2 起到的作用是________。
【题目】我国自主设计的大型客机成功试飞,首艘国产航母正式下水,标志着我国的金属材料制造技术取得重大突破。根据所学知识回答下列问题:
金属 | A | B | C | D |
导电性(以100为标准) | 99 | 61 | 17 | 7.9 |
密度/ (g﹒cm-3) | 8.92 | 2.70 | 7.86 | 11.3 |
熔点/°C | 1083 | 660 | 1535 | 327 |
硬度(以10为标准) | 3 | 2.7 | 5 | 1.5 |
(1)常温下一些金属的物理性质数据如表。据此可知高压输电线最好选用金属_____________(填字母): C的合金通常可以做菜刀、锤子等。其合金的硬度_____________5(填“>”、“<”或“=”).
(2)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等,写出磁铁矿的主要成分与一氧化碳反应炼铁的化学方程式___________________________。
(3)铬(Cr)也是一种重要的金属元素,铬单质及其化合物应用广泛。重铬酸钾(K2Cr2O7)可用于测试酒驾,则重铬酸钾中铬元素的化合价为__________________。
(4)铬桶可以盛装AlCl3溶液,不能盛装稀硫酸,则金属活动性,Cr__________ Al(填“>” 或“<”)。根据上述信息,不能证明Zn和Cr的活动性强弱的试剂组是__________________。
a Zn、Cr和稀硫酸
b Cr、ZnSO4溶液
c Cu、ZnSO4溶液、CrSO4溶液
(5)Cr2(SO4)3为有毒的重金属盐,可用NaOH溶液将其转化为沉淀而除去,该转化的化学方程式为__________________。