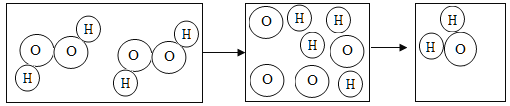
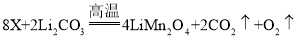题目内容
【题目】下列图像能正确反应其对应关系的是()
A.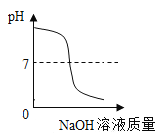 向一定体积的稀硫酸中逐滴加入足量的氢氧化钠溶液
向一定体积的稀硫酸中逐滴加入足量的氢氧化钠溶液
B.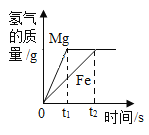 向足量的镁和铁中加入等质量、等质量分数的稀硫酸
向足量的镁和铁中加入等质量、等质量分数的稀硫酸
C.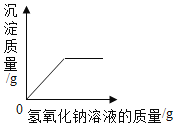 向硫酸镁和硫酸的混合溶液中逐渐加入氢氧化钠溶液
向硫酸镁和硫酸的混合溶液中逐渐加入氢氧化钠溶液
D.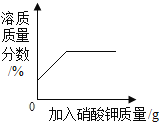 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
【答案】B
【解析】
A、向一定体积的稀硫酸中逐滴加入足量的氢氧化钠溶液,pH应该是由小于7逐渐升高,直至等于或大于7,该选项对应关系不正确;
B、向足量的镁和铁中加入等质量、等质量分数的稀硫酸,最终生成氢气质量相等,由于镁比铁活泼,反应需要时间短,该选项对应关系正确;
C、向硫酸镁和硫酸的混合溶液中逐渐加入氢氧化钠溶液,氢氧化钠先和硫酸反应生成硫酸钠和水,后和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,该选项对应关系不正确;
D、某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体,硝酸钾不能溶解,溶质质量分数不变,该选项对应关系不正确。
故选B。

【题目】食品工业中碘化钾(KI)可用作营养增补剂。碘化钾是白色固体,在空气中久置会“泛黄”变质。某实验小组对碘化钾变质后的成分及变质的条件进行探究。
I.探究变质后的固体成分
(查阅资料)淀粉溶液遇碘(I2)变蓝。
(进行实验)
实验 1
编号 | ① | ② |
操作及现象 | 加热变质后的 KI 固体,黄色消失, 产生的紫色蒸气使淀粉溶液变蓝。 | 向变质后的 KI 固体中滴加稀盐酸, 产生的气体使澄清石灰水变浑浊。 |
II.探究变质的条件
(猜想与假设)常温下,KI 固体“泛黄”变质可能与 O2、CO2 和水蒸气有关。
(进行实验)
实验 2:利用下图装置和表中所列物质分别进行实验,放置相同时间,现象如下表。
装置 | 编号 | ① | ② | ③ | ④ |
| 试管中的物质 | O2 和 H2O | O2 和 CO2 | H2O 和 CO2 | O2、CO2 和H2O |
固体颜色 | 无明显变化 | 无明显变化 | 无明显变化 | 固体泛黄 |
(解释与结论)
(1)实验 1 中石灰水变浑浊的原因是_________(用化学方程式表示)。
(2)由实验 1 中现象推知,“泛黄”变质后的固体中含有的物质是________。
(3)由实验 2 得出“KI 变质一定与 O2 有关”的结论,依据的两个实验是________(填编号)。
(4)由实验 2 推知,KI“泛黄”变质的条件是_________。
III.依据初步结论,深入探究变质的条件
实验 3:分别取相同浓度的 KI 溶液进行实验,在空气中放置相同时间,现象如下表。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
溶液颜色 | 无色 | 浅黄色 | |||
(5)实验 3 中,观察到③~⑤溶液颜色依次加深,推测其原因是________。
(6)由实验 3 推知,KI 固体久置“泛黄”变质过程中,CO2 起到的作用是________。
【题目】氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶于水和酸)为原料制备高纯氧化镁的实验流程如下:
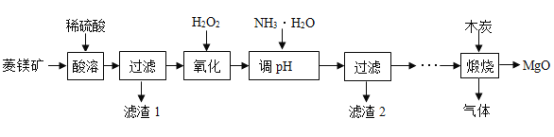
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、____________。MgCO3与稀硫酸反应的化学方程式为_________________。
(2)“氧化”过程中,将FeSO4全部转化为Fe2(SO4) 3,然后加氨水,调节溶液的PH范围为______________。(已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表)
对应离子 | Fe3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 2.7 | 7.9 | 9.4 |
完全沉淀时的pH | 3.7 | 9.6 | 11.4 |
(3)过滤后得到滤渣2和滤液,滤渣2是______(填化学式),此时滤液中的阳离子一定含有____________(填离子符号)。
(4)煅烧过程存在以下反应:![]() ;
;![]() ;
;![]()
已知:①硫在常温下是一种淡黄色固体,硫的熔点约为115.2°C,沸点约为444.7°C;②高锰酸钾溶液与SO2反应会褪色,且只吸收SO2,不吸收CO2;③碱溶液既吸收SO2,又吸收CO2。利用下图装置对煅烧产生的气体进行检验并收集。
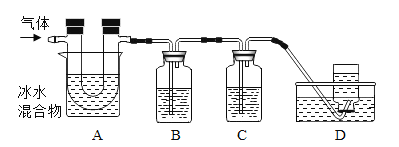
①集气瓶B中盛放的溶液是_______________(填字母),C中盛放的溶液是_____________(填字母)。
a Ca(OH)2溶液
b KMnO4溶液
c NaOH溶液
d BaCl2溶液
②装置D的作用是__________________________。