题目内容
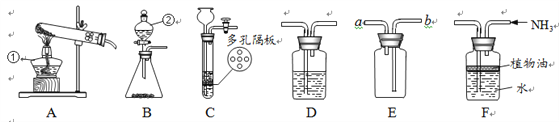
【题目】下图为实验室炼铁的改进装置(部分夹持仪器略去),请回答下列问题:
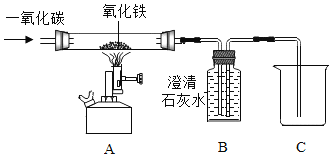
(1)装置A中硬质玻璃管内发生反应的化学方程式是_________________。
(2)实验过程中,先通入一氧化碳后加热,这样操做的目的是_________________。
(3)盛满足量澄清石灰水的B装置在此实验中的作用:①检验并吸收生成的二氧化碳;②_________________。
(4)有同学提出实验后得到的黑色粉末中还可能含有Fe3O4。已知: Fe3O4能溶于稀H2SO4,且有Fe2+和Fe3+生成,其中Fe3+遇到硫氰化钾溶液显血红色。为证明黑色粉末成分,该同学取少量样品于烧杯中,加入过量稀H2SO4,充分反应后,滴加少量硫氰化钾溶液,证明黑色粉末中含有Fe和Fe3O4的现象是_________________。
【答案】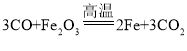 排尽装置内的空气,防止不纯的一氧化碳点燃发生爆炸等合理表述 收集多余的CO等合理答案 有气泡产生,且溶液呈血红色等合理表述
排尽装置内的空气,防止不纯的一氧化碳点燃发生爆炸等合理表述 收集多余的CO等合理答案 有气泡产生,且溶液呈血红色等合理表述
【解析】
(1)一氧化碳在高温下还原氧化铁,生成铁和二氧化碳。故答案为: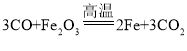 ;
;
(2)进行一氧化碳还原氧化铁的实验时,应该先通入一段时间的CO,然后在进行加热。这样做的目的是因为CO是一种可燃性气体,若CO不纯净,点燃会爆炸,则先通入一段时间的CO,可以排尽装置内的空气,防止不纯的一氧化碳点燃发生爆炸。故答案为:排尽装置内的空气,防止不纯的一氧化碳点燃发生爆炸等合理表述;
(3)盛满足量澄清石灰水的B装置既可以检验并吸收生成的二氧化碳,而没有反应的一氧化碳,由于难溶于水,所以进入B装置中后,会将装置内的澄清的石灰水压入C装置中,从而达到收集多余的一氧化碳的效果。故答案为:收集多余的CO等合理答案;
(4)要证明黑色粉末的成分中含有Fe和Fe3O4,加入过量的稀硫酸,则铁和稀硫酸反应生成硫酸亚铁和氢气,会产生气泡。四氧化三铁与硫酸反应生成硫酸亚铁、硫酸铁,滴入少量的硫氰化钾溶液,则溶液会变为血红色。故答案为:有气泡产生,且溶液呈血红色。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】食品工业中碘化钾(KI)可用作营养增补剂。碘化钾是白色固体,在空气中久置会“泛黄”变质。某实验小组对碘化钾变质后的成分及变质的条件进行探究。
I.探究变质后的固体成分
(查阅资料)淀粉溶液遇碘(I2)变蓝。
(进行实验)
实验 1
编号 | ① | ② |
操作及现象 | 加热变质后的 KI 固体,黄色消失, 产生的紫色蒸气使淀粉溶液变蓝。 | 向变质后的 KI 固体中滴加稀盐酸, 产生的气体使澄清石灰水变浑浊。 |
II.探究变质的条件
(猜想与假设)常温下,KI 固体“泛黄”变质可能与 O2、CO2 和水蒸气有关。
(进行实验)
实验 2:利用下图装置和表中所列物质分别进行实验,放置相同时间,现象如下表。
装置 | 编号 | ① | ② | ③ | ④ |
| 试管中的物质 | O2 和 H2O | O2 和 CO2 | H2O 和 CO2 | O2、CO2 和H2O |
固体颜色 | 无明显变化 | 无明显变化 | 无明显变化 | 固体泛黄 |
(解释与结论)
(1)实验 1 中石灰水变浑浊的原因是_________(用化学方程式表示)。
(2)由实验 1 中现象推知,“泛黄”变质后的固体中含有的物质是________。
(3)由实验 2 得出“KI 变质一定与 O2 有关”的结论,依据的两个实验是________(填编号)。
(4)由实验 2 推知,KI“泛黄”变质的条件是_________。
III.依据初步结论,深入探究变质的条件
实验 3:分别取相同浓度的 KI 溶液进行实验,在空气中放置相同时间,现象如下表。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
溶液颜色 | 无色 | 浅黄色 | |||
(5)实验 3 中,观察到③~⑤溶液颜色依次加深,推测其原因是________。
(6)由实验 3 推知,KI 固体久置“泛黄”变质过程中,CO2 起到的作用是________。