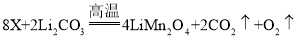题目内容
【题目】下图是某同学所在化学活动实验小组同学的实验,他们在探究稀硫酸的某些化学性质,请回答下列问题:(如图)
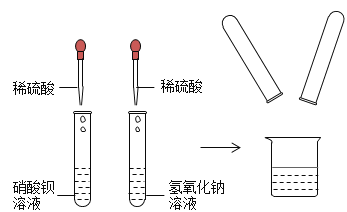
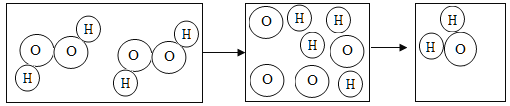
请写出右边试管中发生的反应方程式:_____。左边试管中的实验现象为_____。甲乙同学实验后,将左边试管过滤后的滤液和右边试管实验后的溶液倒入同一只烧杯中,观察到有白色沉淀生成,由此可知左边试管中溶质为_____,将烧杯中的沉淀滤去,得到滤液。
(提出问题)烧杯中滤液的溶质中离子除了Na和NO3-外,甲同学的猜想:OH-、SO42-
乙同学的猜想:OH-、Ba2
丙同学的猜想:H+、Ba2
还含有哪些离子?_________
(实验验证)丙同学为了验证自己的猜想,取烧杯中的溶液少许于试管中,向其中加入少量的硫酸钠溶液,观察到产生白色沉淀的现象,于是得出结论:自己的猜想正确,甲的猜想不正确。乙同学认为丙得出的结论不正确。请对丙同学的实验及现象做出评价_____。
乙同学进行了自己的验证实验,取少量烧杯中的溶液于试管中,向其中滴加硫酸铜溶液,观察到有白色和蓝色沉淀的现象,于是得出结论:其溶质中的离子成分是_____。
(反思与总结)乙、丙两位同学的实验所选用的试剂不同,得出结论也不相同,由两位同学的验证实验总结得出:在验证猜想的溶液中溶质离子成分时,所选试剂要求是_____就能一次性验证溶质离子成分。
【答案】![]() 无色溶液中产生白色沉淀 Ba(NO3)2,HNO3 H+、SO42- 不正确,加入硫酸钠溶液产生白色沉淀,只能证明含有钡离子,无法证明是否含有氢离子,所以丙同学猜想正确不成立。 OH-,Ba2+,Na+,NO3- 所加试剂与待测离子均发生反应,产生明显不同的现象
无色溶液中产生白色沉淀 Ba(NO3)2,HNO3 H+、SO42- 不正确,加入硫酸钠溶液产生白色沉淀,只能证明含有钡离子,无法证明是否含有氢离子,所以丙同学猜想正确不成立。 OH-,Ba2+,Na+,NO3- 所加试剂与待测离子均发生反应,产生明显不同的现象
【解析】
左边试管中硫酸与硝酸钡反应生成硫酸钡的白色沉淀,故现象为有白色沉底生成,右边试管中氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O。甲乙同学实验后,将左边试管过滤后的滤液和右边试管实验后的溶液倒入同一只烧杯中,烧杯中观察到有白色沉淀生成,只能是硫酸根与钡离子生成沉淀,故左边试管中既有剩余的硝酸钡又有反应生成的硝酸;
[提出问题]
烧杯中有白色沉淀,硫酸根离子与钡离子不能同时存在,反应后可能是氢氧化钠和硫酸钠过量,或氢氧化钠和硝酸钡过量,或硝酸和硝酸钡过量,还可能是硫酸和硫酸钠过量,即为H+、SO42-;
[实验验证]
丙同学的实验只能证明溶液中含有钡离子,不能证明是否含氢离子,故有片面性;
乙同学实验中硫酸根与钡离子生成硫酸钡沉淀,铜离子与氢氧根离子生成氢氧化铜的蓝色沉淀,说明溶质中的离子含有OH-、Ba2+;所以其溶质中的离子成分是Na+、NO3-、OH-、Ba2+;
[反思与总结]
乙同学进行实验所选试剂既能鉴别出氢氧根离子又能鉴别出钡离子,所以在验证猜想的溶液中溶质离子成分时,所选试剂要求是与可能存在的离子都发生化学反应,且产生不同的现象就能一次性验证溶质离子成分。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】我国自主设计的大型客机成功试飞,首艘国产航母正式下水,标志着我国的金属材料制造技术取得重大突破。根据所学知识回答下列问题:
金属 | A | B | C | D |
导电性(以100为标准) | 99 | 61 | 17 | 7.9 |
密度/ (g﹒cm-3) | 8.92 | 2.70 | 7.86 | 11.3 |
熔点/°C | 1083 | 660 | 1535 | 327 |
硬度(以10为标准) | 3 | 2.7 | 5 | 1.5 |
(1)常温下一些金属的物理性质数据如表。据此可知高压输电线最好选用金属_____________(填字母): C的合金通常可以做菜刀、锤子等。其合金的硬度_____________5(填“>”、“<”或“=”).
(2)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等,写出磁铁矿的主要成分与一氧化碳反应炼铁的化学方程式___________________________。
(3)铬(Cr)也是一种重要的金属元素,铬单质及其化合物应用广泛。重铬酸钾(K2Cr2O7)可用于测试酒驾,则重铬酸钾中铬元素的化合价为__________________。
(4)铬桶可以盛装AlCl3溶液,不能盛装稀硫酸,则金属活动性,Cr__________ Al(填“>” 或“<”)。根据上述信息,不能证明Zn和Cr的活动性强弱的试剂组是__________________。
a Zn、Cr和稀硫酸
b Cr、ZnSO4溶液
c Cu、ZnSO4溶液、CrSO4溶液
(5)Cr2(SO4)3为有毒的重金属盐,可用NaOH溶液将其转化为沉淀而除去,该转化的化学方程式为__________________。
【题目】氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶于水和酸)为原料制备高纯氧化镁的实验流程如下:
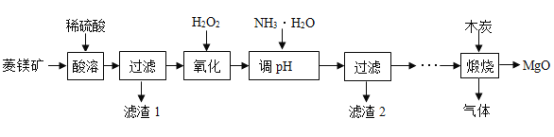
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、____________。MgCO3与稀硫酸反应的化学方程式为_________________。
(2)“氧化”过程中,将FeSO4全部转化为Fe2(SO4) 3,然后加氨水,调节溶液的PH范围为______________。(已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表)
对应离子 | Fe3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 2.7 | 7.9 | 9.4 |
完全沉淀时的pH | 3.7 | 9.6 | 11.4 |
(3)过滤后得到滤渣2和滤液,滤渣2是______(填化学式),此时滤液中的阳离子一定含有____________(填离子符号)。
(4)煅烧过程存在以下反应:![]() ;
;![]() ;
;![]()
已知:①硫在常温下是一种淡黄色固体,硫的熔点约为115.2°C,沸点约为444.7°C;②高锰酸钾溶液与SO2反应会褪色,且只吸收SO2,不吸收CO2;③碱溶液既吸收SO2,又吸收CO2。利用下图装置对煅烧产生的气体进行检验并收集。
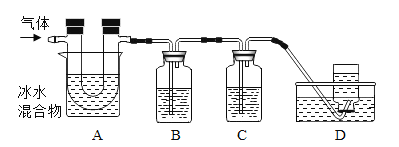
①集气瓶B中盛放的溶液是_______________(填字母),C中盛放的溶液是_____________(填字母)。
a Ca(OH)2溶液
b KMnO4溶液
c NaOH溶液
d BaCl2溶液
②装置D的作用是__________________________。