题目内容
【题目】酸、碱、盐是初中化学学习的重要知识。根据所学知识,某化学兴趣小组设计了如下两个实验,探究氢氧化钠与二氧化碳的反应。
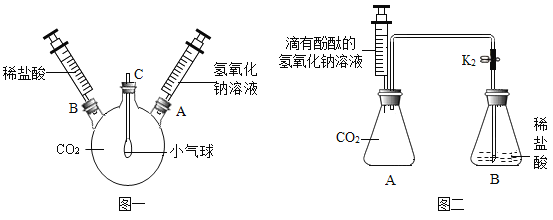
(1)如图一装置所示,先将氢氧化钠溶液注入三颈烧瓶中,然后再将稀盐酸注入三颈烧瓶中,观察到气球的变化是________________,产生这一现象的原因是_______________。
(2)根据实验一的原理,兴趣小组的同学又设计了图二装置。实验前关闭K,先将注射器中的氢氧化钠溶液注入A中,然后再打开K,稀盐酸倒流进A中,片刻后停止倒流,A中溶液仍为红色。同学们对反应后A装置中的溶液成分产生了兴趣,提出了如下猜想:
猜想一: NaCl、 Na2CO3
猜想二: NaCl、 NaOH
猜想三: NaCl、NaOH、Na2CO3
①上述猜想不合理的是___________,原因是______。
同学们经过讨论设计了如下实验方案进行探究
实验操作 | 实验现象 | 实验结论或化学方程式 |
②__________________ | 有白色沉淀产生 | ③反应的化学方程式__________ |
静置,取上层清液,向其中滴加酚酞溶液 | ④_________________ | 猜想三成立 |
(3)上述实验结束后,兴趣小组的同学想将溶液的溶质都变为NaCl。他们向装置A中加入20g溶质质量分数为7.3%稀盐酸,恰好使红色完全退去,试计算反应后NaCl的质量增加了_______?
【答案】气球先膨胀后恢复原状 先注入氢氧化钠溶液,氢氧化钠与二氧化碳反应,气体减少使三颈烧瓶中压强减小,大气压使气球膨胀,后注入稀盐酸,稀盐酸与生成的碳酸钠反应生成二氧化碳,使压强恢复,气球恢复原状 猜想二 稀盐酸先与氢氧化钠反应,后与碳酸钠反应,当有氢氧化钠存在时,必定含有碳酸钠 取少量待测液于试管中,加入足量的氯化钡(或氯化钙) ![]() 溶液变红 2.34g
溶液变红 2.34g
【解析】
(1)先注入氢氧化钠溶液,氢氧化钠与二氧化碳反应,气体减少使三颈烧瓶中压强减小,大气压使气球膨胀,后注入稀盐酸,稀盐酸与生成的碳酸钠反应生成二氧化碳,使压强恢复,气球恢复原状。
(2)①图二实验,实验前关闭K,先将注射器中的氢氧化钠溶液注入A中,氢氧化钠与锥形瓶中的二氧化碳反应生成碳酸钠和水,气体减少使锥形瓶中压强减小,然后再打开K,稀盐酸倒流进A中,若锥形瓶中含有过量的氢氧化钠,稀盐酸先与氢氧化钠反应后与碳酸钠反应,因为溶液显红色,所以稀盐酸量不足,锥形瓶中的溶液是氯化钠、碳酸钠或氯化钠、碳酸钠和氢氧化钠,因此猜想二不合理。
②猜想一与猜想三的差异是是否有NaOH,检验是否含有NaOH,用酚酞溶液,但是溶液中碳酸钠的水溶液显碱性,因此先除去碳酸钠,然后再检验氢氧化钠,根据实验现象有白色沉淀产生,可知步骤是取少量待测液于试管中,加入足量的BaCl2(或CaCl2),发生的化学方程式:![]() ;静置,取上层清液,向其中滴加酚酞溶液,根据实验结论是猜想三成立,即含有氢氧化钠,可知实验现象是溶液变红。
;静置,取上层清液,向其中滴加酚酞溶液,根据实验结论是猜想三成立,即含有氢氧化钠,可知实验现象是溶液变红。
(3)根据实验探究知实验二锥形瓶中最终的溶质是NaCl、Na2CO3、NaOH,兴趣小组的同学想将溶液的溶质都变为NaCl,向装置中加入稀盐酸,发生的化学方程式:![]() 、
、![]() ,加入20g溶质质量分数为7.3%稀盐酸,恰好使红色完全退去,说明恰好完全反应,则稀盐酸中的氯元素全部转化为氯化钠,可根据稀盐酸的量计算生成的氯化钠的质量。
,加入20g溶质质量分数为7.3%稀盐酸,恰好使红色完全退去,说明恰好完全反应,则稀盐酸中的氯元素全部转化为氯化钠,可根据稀盐酸的量计算生成的氯化钠的质量。
解:设反应后氯化钠的质量增加x;
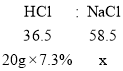
![]()
x=2.34g
或者可根据元素守恒计算新增氯化钠的质量,所消耗的稀盐酸溶质的质量:![]() ,所消耗的稀盐酸中氯元素的质量:
,所消耗的稀盐酸中氯元素的质量:![]() ,则对应生成的NaCl:
,则对应生成的NaCl:![]() 。
。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
(1)20℃时,NaCl的溶解度是__g.
(2)根据表内数据可知,KNO3和NaCl溶解度相等的温度取值范围是__.
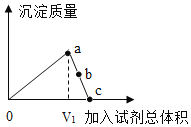
(3)如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答:
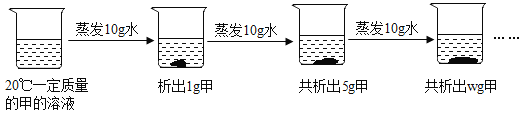
①蒸发前原溶液是__(填“饱和”和“不饱和”)溶液.
②w的数值是__.
③依据上述实验,你认为甲的溶解度随温度变化的趋势是__(填编号).
A随温度升高而增大 B随温度升高而减小 C无法判断