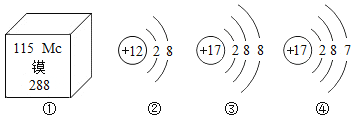��Ŀ����
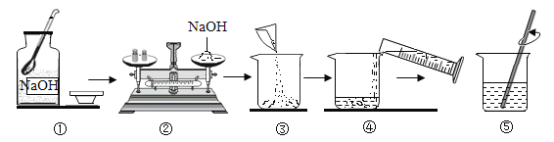
����Ŀ�����������ڹ���������������Ҫ�����ã�ͼ1Ϊ�ߩ�15�ɻ�������������ɣ�
��1�����Ͻ���������ɻ�����ǣ����Ͻ���ʵ���Ҫ�ŵ���______��д��һ�㼴�ɣ���
��2����װǰ�������������⼣�߰ߣ���������ʴ��Ҫ����������е�_______��ͬ���õĽ������ҵ�����г���ϡ�����ȥ����Ʒ��������⣬�÷�Ӧ�Ļ�ѧ����ʽΪ______.
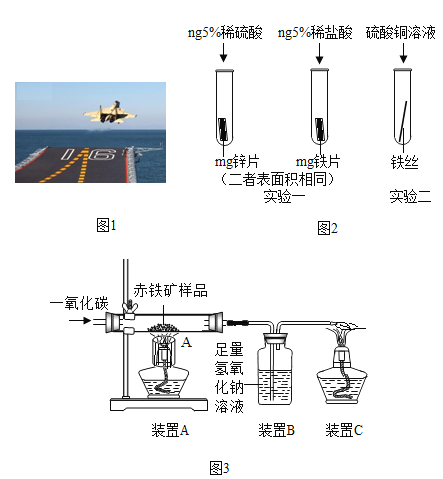
��3��Ϊ�˱����ִ��ĸ�����DZ���ʴ��ͨ�����ִ��������Ƕ�������ǿ������С��Ϊ̽��п������ͭ���ֽ����Ļ��˳���������ͼ2������ʵ�飺
��ʵ��һ�У�С��������������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ����������������_______��
��ʵ����У�������__����֤�����Ļ��ǿ��ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
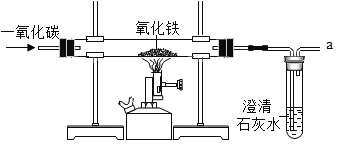
��4���������Ľ���ķ��˴����ĸֲģ�ij��ȤС����ʵ������ͼ3��ʾװ��ģ�������Ļ�ѧԭ�������ⶨ��������������������������װ�����������ã���Ӧ��ȫ�ҳ������е����ʲ��μӷ�Ӧ�����س�������Ʒ������Ϊwg����
��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ____��
��Ҫ�ⶨ�ó�������Ʒ����������������������Ҫ������������__��__��
���𰸡�ǿ�ȴ��������ȣ������𰸺������ɣ� ˮ������ ![]() ѡȡ��������ͬ ��˿������ֺ�ɫ���ʣ���Һ����ɫ��Ϊdz��ɫ
ѡȡ��������ͬ ��˿������ֺ�ɫ���ʣ���Һ����ɫ��Ϊdz��ɫ ![]()
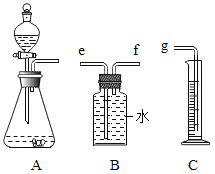
![]() ��Ӧ��װ��A��ҩƷ������ �����Ӧǰ��װ��B���ӵ�����
��Ӧ��װ��A��ҩƷ������ �����Ӧǰ��װ��B���ӵ�����
��������
��1�����Ͻ��������ĺϽ𣬾���ǿ�ȴ���ʴ��ǿ����������ŵ㣻
��2����������ʴ��Ҫ����������е�������ˮ��ͬ���õĽ����
��ҵ�����г���ϡ�����ȥ����Ʒ��������⣬�������Ҫ�ɷ�����������������������������ϡ���ᷴӦ�����Ȼ�����ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��3���� ��ͼ�п��Կ�����ѡȡ����һ����ϡ���ᡢһ����ϡ���ᣬѡȡ������ͬ�����ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ�������������ѡȡ��������ͬ��
������˿�����к�ɫ������������Һ����ɫ��Ϊdz��ɫ��˵������������ͭ��Ӧ��������������ͭ��˵�����Ľ�����Ա�ͭǿ���÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��4���ٳ��������Ҫ�ɷ���������������������������һ����̼�ڸ��µ������·�Ӧ�������Ͷ�����̼��������̼�����������Ʒ�Ӧ����̼���ƺ�ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��Ҫ�ⶨ�ó�������Ʒ����������������������֪��������Ʒ���������ʻ�������������������������һ����̼�ڸ��µ������·�Ӧ�������Ͷ�����̼����Ӧ��װ��A��ҩƷ�������ɵ������ʿɲ����Ӧ��װ��A��ҩƷ���������ٸ�������������������������������������������շ�Ӧ���ɵĶ�����̼���ʷ�Ӧǰ��װ��B���ӵ����������Ƿ�Ӧ���ɵĶ�����̼���������ʲ����Ӧǰ��װ��B���ӵ����������ݶ�����̼������������������������������Ӧ��װ��A��ҩƷ�������������Ӧǰ��װ��B���ӵ�������

 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�����Ŀ���ᡢ����dz��л�ѧѧϰ����Ҫ֪ʶ��������ѧ֪ʶ��ij��ѧ��ȤС���������������ʵ�飬̽�����������������̼�ķ�Ӧ��
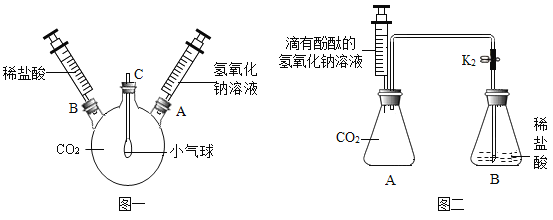
��1����ͼһװ����ʾ���Ƚ�����������Һע��������ƿ�У�Ȼ���ٽ�ϡ����ע��������ƿ�У��۲쵽����ı仯��________________��������һ�����ԭ����_______________��
��2������ʵ��һ��ԭ������ȤС���ͬѧ�������ͼ��װ�á�ʵ��ǰ�ر�K���Ƚ�ע�����е�����������Һע��A�У�Ȼ���ٴ�K��ϡ���ᵹ����A�У�Ƭ�̺�ֹͣ������A����Һ��Ϊ��ɫ��ͬѧ�ǶԷ�Ӧ��Aװ���е���Һ�ɷֲ�������Ȥ����������²���:
����һ: NaCl�� Na2CO3
�����: NaCl�� NaOH
������: NaCl��NaOH��Na2CO3
���������벻��������___________��ԭ����______��
ͬѧ�Ǿ����������������ʵ�鷽������̽��
ʵ����� | ʵ������ | ʵ����ۻ�ѧ����ʽ |
��__________________ | �а�ɫ�������� | �۷�Ӧ�Ļ�ѧ����ʽ__________ |
���ã�ȡ�ϲ���Һ�������еμӷ�̪��Һ | ��_________________ | ���������� |
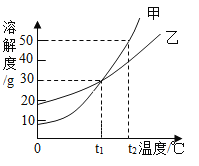
��3������ʵ���������ȤС���ͬѧ�뽫��Һ�����ʶ���ΪNaCl��������װ��A�м���20g������������Ϊ7.3%ϡ���ᣬǡ��ʹ��ɫ��ȫ��ȥ���Լ��㷴Ӧ��NaCl������������_______?