题目内容
【题目】(1)三大化石燃料是指煤、____________和天然气,它们都是不可再生能源。天然气的主要成分是甲烷,其燃烧的化学方程式为_______________.
(2)可燃物燃烧的条件之一是____________________(任写一条即可,下一空同样),灭火的原理就是任意破坏一个燃烧的条件,所以生活中扑灭油锅着火的方法有______________________。
(3)水蒸气与炽热的炭反应可生成一氧化碳和氢气,其反应的化学方程式为:________,基本反应类型是________________.
【答案】石油 CH4+2O2![]() CO2+2H2O 与氧气接触或温度达到着火点 用锅盖盖灭 C+H2O
CO2+2H2O 与氧气接触或温度达到着火点 用锅盖盖灭 C+H2O![]() CO+H2 置换反应
CO+H2 置换反应
【解析】
(1)化石燃料包括煤、石油、天然气;天然气的主要成分是甲烷,甲烷燃烧生成二氧化碳和水,其燃烧的化学方程式为:CH4+2O2![]() CO2+2H2O;故填:石油;CH4+2O2
CO2+2H2O;故填:石油;CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(2)物质燃烧条件:可燃物;与氧气接触,温度达到着火点,三个条件同时具备;灭火的原理就是任意破坏一个燃烧的条件,所以生活中扑灭油锅着火的方法是用锅盖盖灭,利用隔绝氧气的原理灭火。故填:与氧气接触或温度达到着火点;用锅盖盖灭;
(3)水蒸气与炽热的炭反应可生成一氧化碳和氢气,其反应的化学方程式为:C+H2O![]() CO+H2,反应物和生成物都是一种单质和一种化合物,属于置换反应。故填:C+H2O
CO+H2,反应物和生成物都是一种单质和一种化合物,属于置换反应。故填:C+H2O![]() CO+H2;置换反应。
CO+H2;置换反应。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】酸、碱、盐是初中化学学习的重要知识。根据所学知识,某化学兴趣小组设计了如下两个实验,探究氢氧化钠与二氧化碳的反应。
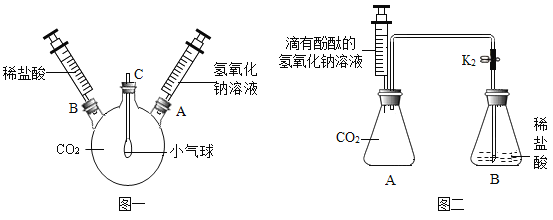
(1)如图一装置所示,先将氢氧化钠溶液注入三颈烧瓶中,然后再将稀盐酸注入三颈烧瓶中,观察到气球的变化是________________,产生这一现象的原因是_______________。
(2)根据实验一的原理,兴趣小组的同学又设计了图二装置。实验前关闭K,先将注射器中的氢氧化钠溶液注入A中,然后再打开K,稀盐酸倒流进A中,片刻后停止倒流,A中溶液仍为红色。同学们对反应后A装置中的溶液成分产生了兴趣,提出了如下猜想:
猜想一: NaCl、 Na2CO3
猜想二: NaCl、 NaOH
猜想三: NaCl、NaOH、Na2CO3
①上述猜想不合理的是___________,原因是______。
同学们经过讨论设计了如下实验方案进行探究
实验操作 | 实验现象 | 实验结论或化学方程式 |
②__________________ | 有白色沉淀产生 | ③反应的化学方程式__________ |
静置,取上层清液,向其中滴加酚酞溶液 | ④_________________ | 猜想三成立 |
(3)上述实验结束后,兴趣小组的同学想将溶液的溶质都变为NaCl。他们向装置A中加入20g溶质质量分数为7.3%稀盐酸,恰好使红色完全退去,试计算反应后NaCl的质量增加了_______?
【题目】下列实验方案不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
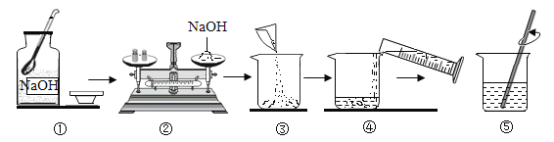
A | 配制50 g 6%的氯化钠溶液 | 称取3 g氯化钠固体溶于47 mL水中 |
B | 鉴别硬水和软水 | 加入肥皂水,振荡,观察现象 |
C | 除去铜粉中少量的木炭 | 将混合物在空气中灼烧 |
D | 除去NaOH溶液中少量的Na2CO3 | 加入适量的Ca(OH)2溶液,充分反应后过滤 |
A.AB.BC.CD.D