题目内容
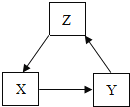
【题目】海水晾晒可得粗盐,粗盐中除NaCl 外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。为了得到纯净的氯化钠,实验操作流程如下:
(1)操作②中,选择除杂试剂时,不能用KOH代替NaOH的理由是什么?__________
(2)过滤后得到的沉淀的成分有哪些?__________
(3)操作④方框内加入的试剂和目的是什么?__________
【答案】会引入新的杂质KCl 泥沙 、BaSO4、Mg(OH)2、CaCO3、BaCO3 稀盐酸,除去过量的NaOH、Na2CO3
【解析】
(1)操作②中,选择除杂试剂时,不能用KOH代替NaOH,是因为用KOH与氯化镁反应会引入新的杂质氯化钾。
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠溶液可以将镁离子转化为沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子转化为沉淀;氯化钡溶液能与硫酸钠溶液反应生成硫酸钡沉淀,氢氧化钠能与氯化镁溶液反应生成氢氧化镁沉淀和氯化钠,碳酸钠能与过量的氯化钡、氯化钙反应,生成碳酸钡、碳酸钙沉淀;完全反应后,再进行过滤,过滤后得到的沉淀的成分是泥沙、氢氧化镁、碳酸钙、碳酸钡、硫酸钡。
(3)滤液中含有过量的氢氧化钠和碳酸钠,操作④方框内加入的试剂应为稀盐酸,目的是除去反应剩余的氢氧根离子和碳酸根离子,
故答案为:
(1)用KOH会引入新的杂质氯化钾;
(2)氢氧化镁、碳酸钙、碳酸钡、硫酸钡;
(3)稀盐酸;除去反应剩余的氢氧根离子和碳酸根离子。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】酸、碱、盐是初中化学学习的重要知识。根据所学知识,某化学兴趣小组设计了如下两个实验,探究氢氧化钠与二氧化碳的反应。
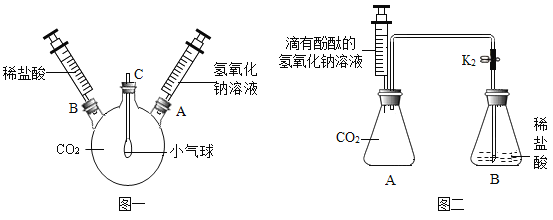
(1)如图一装置所示,先将氢氧化钠溶液注入三颈烧瓶中,然后再将稀盐酸注入三颈烧瓶中,观察到气球的变化是________________,产生这一现象的原因是_______________。
(2)根据实验一的原理,兴趣小组的同学又设计了图二装置。实验前关闭K,先将注射器中的氢氧化钠溶液注入A中,然后再打开K,稀盐酸倒流进A中,片刻后停止倒流,A中溶液仍为红色。同学们对反应后A装置中的溶液成分产生了兴趣,提出了如下猜想:
猜想一: NaCl、 Na2CO3
猜想二: NaCl、 NaOH
猜想三: NaCl、NaOH、Na2CO3
①上述猜想不合理的是___________,原因是______。
同学们经过讨论设计了如下实验方案进行探究
实验操作 | 实验现象 | 实验结论或化学方程式 |
②__________________ | 有白色沉淀产生 | ③反应的化学方程式__________ |
静置,取上层清液,向其中滴加酚酞溶液 | ④_________________ | 猜想三成立 |
(3)上述实验结束后,兴趣小组的同学想将溶液的溶质都变为NaCl。他们向装置A中加入20g溶质质量分数为7.3%稀盐酸,恰好使红色完全退去,试计算反应后NaCl的质量增加了_______?
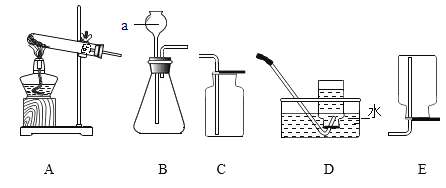
【题目】下列实验方案不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 配制50 g 6%的氯化钠溶液 | 称取3 g氯化钠固体溶于47 mL水中 |
B | 鉴别硬水和软水 | 加入肥皂水,振荡,观察现象 |
C | 除去铜粉中少量的木炭 | 将混合物在空气中灼烧 |
D | 除去NaOH溶液中少量的Na2CO3 | 加入适量的Ca(OH)2溶液,充分反应后过滤 |
A.AB.BC.CD.D