��Ŀ����
����Ŀ����ѧԪ�����ڱ��ǻ�ѧѧϰ����Ҫ���ߣ��밴Ҫ������
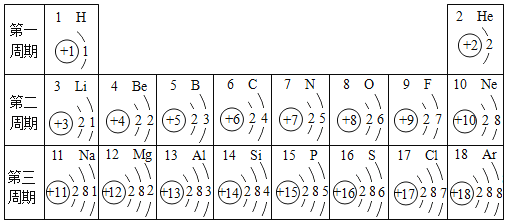
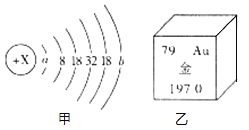
��1��Ԫ�����ڱ��Ǹ���_____����Ļ�ѧԪ���б���Ԫ�����ڱ���7�����ڣ�16���塣��д���ϱ��еĵ�һ����Ԫ������_____��
��2���о���������ͬһ�����У������ң�ԭ��ʧȥ���ӵ������������õ����ӵ���������ǿ����˳�ϡ������Ԫ���⣬ͬһ����Ԫ�ؽ�������_____�����ǿ����������ͬ�����ǽ�������_____���ǽ�����Խǿ��������������Ӧ�ĺ���������Խǿ������H2SiO3����H3PO4����H2SO4����HClO4�������У�������ǿ����������˳����_____������ţ���
��3����13��Ԫ����ؿ��к�������Ԫ����ɵ���������NaOH��Һ��Ӧ������ƫ�����Σ���AlO2�����Σ����÷�Ӧ�Ļ�ѧ����ʽΪ_____��
��4����9��Ԫ���γɵ�����������SiO2������Ӧ�õ������������ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ��_____��
���𰸡�ԭ������ ��Ԫ�ء��Ԫ�ء���Ԫ�� ���� ��ǿ �ܢۢڢ� Al2O3+2NaOH��2NaAlO2+H2O SiO2+4HF��SiF4��+2H2O
��������
ͬһ���ڣ�ϡ��������⣩�������ң�����ԭ�������ĵ�����Ԫ��ԭ�ӵİ뾶�ݼ��� ͬһ���У����ϵ��£�����ԭ�������ĵ�����Ԫ��ԭ�Ӱ뾶�����������������������������������������Ʒ�Ӧ����ƫ�����ƺ�ˮ�����������������跢����Ӧ�õ������������ˮ��
��1��Ԫ�����ڱ��Ǹ���ԭ����������Ļ�ѧԪ���б���Ԫ�����ڱ���7�����ڣ�16���壻
�ϱ��еĵ�һ����Ԫ��������Ԫ�ء��Ԫ�ء���Ԫ�ء�
��2����ϡ������Ԫ���⣬ͬһ����Ԫ�ؽ������������ǽ���������ǿ��
����H2SiO3����H3PO4����H2SO4����HClO4�������У���Ԫ�ء���Ԫ�ء���Ԫ�ء���Ԫ�صĻ��ϼ۷ֱ���+4��+5��+6��+7��������ǿ����������˳�����ܢۢڢ���
��3����13��Ԫ������Ԫ�أ���ؿ��к�������Ԫ����Ԫ����ɵ�������������������NaOH��Һ��Ӧ������ƫ�����ƺ�ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ![]()
��4����9��Ԫ���Ƿ�Ԫ�أ��γɵ�������������ᣬ���������SiO2������Ӧ�õ������������ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ![]()

 ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д� Ӣ�ŵ��ϵ�д�
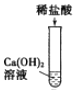
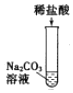
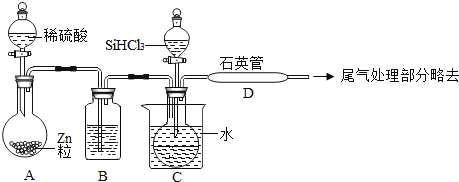
Ӣ�ŵ��ϵ�д�����Ŀ��Ϊ̽����Ļ�ѧ���ʣ�ij��ѧС�������������������ʵ�������
ʵ�� | A | B | C | D | E |
��ش�
(1)д��E�з�Ӧ�Ļ�ѧ����ʽ______��
(2)����Ӧ��D��E�Թ��еķ�Һ����һ���ྻ���ձ��У��۲쵽�ձ����������ݲ��������а�ɫ�������֡����ձ��еĻ������ˣ��õ���ɫ��������ɫ��Һ��ͬѧ�Ƕ���Һ�����ʵijɷֽ�������̽����
��������⣩��Һ�����ʵijɷ���ʲô��
���������룩
����һ��NaCl
�������NaCl��CaCl2
��������NaCl��CaCl2��Na2CO3
�����ģ�______��
���������ۣ��������ۣ�ͬѧ��һ����Ϊ����______�Ǵ���ġ�
�����ʵ�飩�����ʵ�鱨�档
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Һ���Թ��У��μ�������̼������Һ | ���������� | ����������� |
ȡ������Һ���Թ��У��μ��Ȼ�����Һ | ______ | �����ij��� |
����˼��չ���ڷ�����ѧ��Ӧ���������ʵijɷ�ʱ����������������迼��____��
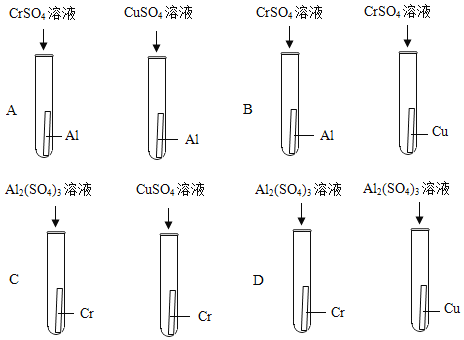
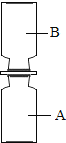
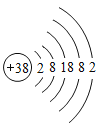
����Ŀ������Cr������Ҫ�Ľ������ϣ�Խ��Խ�ܵ����ǵĹ�ע��ij��ѧ��ȤС���Cr��Al��Cu�Ľ������˳�����̽�����������£�
��������裩
��1������ѧ֪ʶ����֪�������ֽ����Ļ��˳���ֶ����ֽ����Ļ��˳��������ֿ��ܵļ��裺
a��Al��Cr��Cu b��Cr��Al��Cu c��_____��
�����ʵ�飩ͬ���£�ȡ��С��ͬ�Ĵ�ĥ���Ľ�����Ƭ���ֱ�Ͷ�뵽�������Ũ�ȵ�����ϡ�����У��۲�����¼���£�
���� | Cr | Al | Cu |
������ ��Ӧ���� | ���ݲ��������� �������ܽ� | ���ݲ������ң� ����Ѹ���ܽ� | �����ݲ����� �����ޱ仯 |
������ʵ��������
��2����ĥ���ֽ���Ŀ���dz�ȥ��������Ĥ���䷢������___�仯��������������ѧ��
���ó����ۣ�
��3��ԭ��������ȷ����_____������a����b������c������д���������ᷴӦ�Ļ�ѧ����ʽ���������ᷴӦ����+2�ۣ���_____��
������Ӧ�ã�
��4������̽�������Ϊ��֤Cr��Al��Cu�Ľ������˳���������ͼ��ʾ��ʵ����������п��Դﵽʵ��Ŀ����_____������ĸ����