题目内容
【题目】下列说法正确的是( )
A. NH4+与Na+的质子数、电子数均相同
B. 13C原子核中有6个质子和7个中子,则14C的原子核中有7个质子和7个中子
C. X的核电荷数为a,它的阳离子Xm+与元素Y的阴离子Yn﹣的电子层结构完全相同,则元素Y的核电荷数是a+m+n
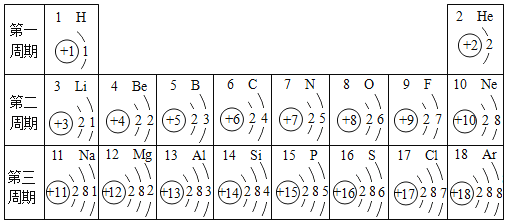
D. 锶(Sr)的原子结构示意图如图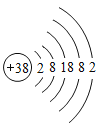 ,锶元素与氯元素结合时所形成化合物的化学式是SrCl2
,锶元素与氯元素结合时所形成化合物的化学式是SrCl2
【答案】AD
【解析】
最外层电子数少于4,在化学反应中易失去电子,核电荷数等于质子数等于核外电子数。
A、Na+中质子数是11个,电子数是10个。NH4+质子数是11,电子数是10,和钠离子中质子数和电子数都相同,故A正确;
B、质子数决定元素的种类,13C原子核中有6个质子和7个中子,则14C的原子核中有6个质子和8个中子,故B不正确;
C、设元素Y的核电荷数是b,因为X的核电荷数为a,它的阳离子Xm+,所以它的离子中带有![]() 个电子,因为阳离子Xm+与元素Y的阴离子Yn﹣电子层结构相同,即核外电子数相同,所以
个电子,因为阳离子Xm+与元素Y的阴离子Yn﹣电子层结构相同,即核外电子数相同,所以![]() ,即
,即![]() ,故C不正确;
,故C不正确;
D、由原子结构示意图可知,锶原子最外层有2个电子,在化学反应中容易失去2个电子而显+2价,氯元素通常显﹣1价,则化合物中定格化学式为SrCl2。故D正确。故选AD。

 名校课堂系列答案
名校课堂系列答案【题目】某校实验室有一瓶久置的铁屑,其成分是铁、氧化铁和水。为测定其中各成分的质量分数,某兴趣小组按下图所示装置进行实验(装置气密性良好;固定装置已略去;氮气不与铁屑中的成分反应;碱石灰是氧化钙和氢氧化钠的混合物)。
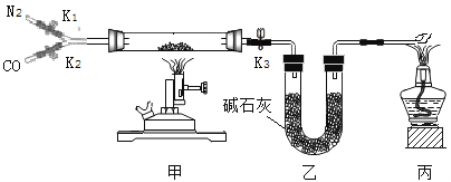
部分实验步骤如下:
Ⅰ.称量硬质玻璃管的质量。将样品放入硬质玻璃管中,称量硬质玻璃管和样品的质量。
II.连接好装置。缓缓通入N2,点燃甲处的酒精喷灯,待硬质玻璃管中固体恒重,记录硬质玻璃管和剩余固体的质量。
Ⅲ.再次连接好装置,继续实验。通入CO,点燃丙处的酒精灯和甲处的酒精喷灯。待硬质玻璃管中固体恒重,熄灭酒精喷灯,继续通入CO直至硬质玻璃管冷却。再次记录硬质玻璃管和剩余固体的质量。
实验数据记录如下表:
硬质玻璃管 | 硬质玻璃管和样品 | 步骤II硬质玻璃 管和剩余固体 | 步骤步骤Ⅲ硬质玻璃 管和剩余固体 | |
质量 | m1 | m2 | m3 | m4 |
请回答下列问题:
(1)步骤Ⅲ丙处酒精灯的作用是____________。
(2)步骤Ⅲ硬质玻璃管中反应的化学方程式为________。
(3)样品中氧化铁的质量分数为_____(用m1、m2、m3、m4的代数式表示)。若步骤Ⅲ中氧化铁没有完全反应,样品中水的质量分数测量结果将______(填“偏大”“偏小”或“不变”)。
(4)有关样品,下列说法正确的是_____(填字母标号)。
A样品中氢元素的质量为1/9(m2-m3) B样品中铁单质和氧化铁的质量总和为m3-m1
C样品中铁单质的质量为m4-m1 D样品中氧元素的质量为m3-m4