题目内容
【题目】废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。已知:Sn+SnCl4=2SnCl2 。
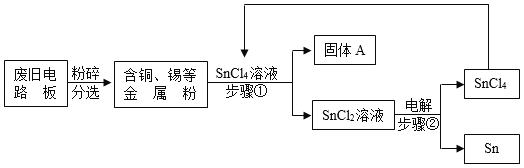
(1)SnCl4中锡元素的化合价是_______________。
(2)铜的金属活动性比锡的________(填“强”或“弱”),固体A中一定含有的金属元素是___________。
(3)写出步骤②发生反应的化学方程式____________,反应的基本类型是______。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是___________(回答一点即可)。
【答案】+4 弱 Cu 2SnCl2![]() Sn+SnCl4 分解反应 避免焚烧塑料产生污染,更加环保(其他合理答案也给分)
Sn+SnCl4 分解反应 避免焚烧塑料产生污染,更加环保(其他合理答案也给分)
【解析】
(1)SnCl4中氯元素的化合价为﹣1,根据化合物中各元素的化合价为零可知,锡元素的化合价为+4;
(2)在金属活动顺序表中铜排在锡之后,铜的金属活动性比锡的弱,所以加入铜不能与SnCl4反应,所以固体A中一定含有的金属元素是Cu;
(3)步骤②中SnCl2在通电的条件下分解生成SnCl4和Sn,化学方程式为:2SnCl2![]() SnCl4+Sn,该反应是由一种物质生成两种物质,该反应属于分解反应;
SnCl4+Sn,该反应是由一种物质生成两种物质,该反应属于分解反应;
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是避免焚烧塑料产生污染,更加环保。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目