题目内容
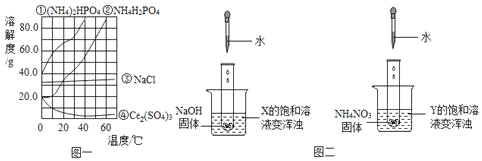
【题目】如图是NaCl、KNO3的溶解度曲线,下列有关说法错误的是( )

A. 0℃时溶解度较大的物质是NaCl
B. 20℃时硝酸钾的溶解度是31.6g
C. 50℃时,饱和NaCl溶液中溶质的质量分数小于饱和KNO3溶液中溶质的质量分数
D. 除去KNO3固体中混有的少量NaCl的方法为:加适量水溶解,加热得到热饱和溶液,冷却结晶析出的是氯化钠固体
【答案】D
【解析】
A、通过分析溶解度曲线可知,0℃时,溶解度较大的物质是NaCl,故A正确;
B、根据溶解度曲线可知,20℃时硝酸钾的溶解度是31.6g,故B正确;
C、一定温度下饱和溶液的溶质质量分数=![]() ,溶解度越大,质量分数越大,50℃时,氯化钠的溶解度小于硝酸钾的溶解度,饱和NaCl溶液中溶质的质量分数小于饱和KNO3溶液中溶质的质量分数,故C正确;
,溶解度越大,质量分数越大,50℃时,氯化钠的溶解度小于硝酸钾的溶解度,饱和NaCl溶液中溶质的质量分数小于饱和KNO3溶液中溶质的质量分数,故C正确;
D、硝酸钾的溶解度受温度变化影响较大,所以除去KNO3固体中混有的少量NaCl的方法为:加适量水溶解,加热得到热饱和溶液,冷却结晶析出的是硝酸钾固体,故D错误。故选D。

【题目】化学与生活、生产密切相关。
(1)我国首架大型客机C919中使用了大量的铝镁合金,铝制品在空气中不易被腐蚀,具有“自我保护”能力,其原因是_____(用化学方程式表示)。
(2)铝、铜、银是日常生活中接触到的三种金属。同学甲设计了如下三个实验来验证它们的金属活动性强弱:① 铝、硝酸银溶液;②铜、硫酸铝溶液;③铜、硝酸银溶液。同学乙认为这一方案中实验 ______(填“①”、“②”、“③”)可以不做,也能验证三个金属的活动性强弱。请写出实验③中的实验现象______。
(3)中国南海海底有大量的可燃冰(CH4·nH2O)。
① 可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N2、CO2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于________(选填“纯净物”或“混合物”)。
②甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | 一氧化碳 |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | 未测 |
根据表格中数据,请完成甲烷在一定量的氧气中燃烧的化学方程式 _______。
(4)某工厂利用废硫酸与废铁屑反应制取硫酸亚铁。现制得FeSO4 1.52 t,需要铁的质量至少是多少?(在答题卡上写出计算过程)_______
【题目】化学兴趣小组打算测定某石灰石样品中的碳酸钙的质量分数(假设杂质分布均匀,杂质不溶于水也不与稀盐酸反应)。他们向大烧杯中先加入47.2g某浓度的稀盐酸,然后将10.0g石灰石样品粉末平均分4次加入,累计产生气体的质量如下:
加入石灰石样品的次数 | 1次 | 2次 | 3次 | 4次 |
累计产生气体的质量 | 0.88g | 1.76g | mg | 2.2g |
请计算:
(1)上表中m=________。
(2)该石灰石样品中碳酸钙的质量分数为__________ 。
(3)计算第四次加入石灰石样品后所得溶液的溶质质量分数____________