题目内容
【题目】研究小组为测定某氯酸钾样品中氯酸钾的含量,称取2.00g该样品,加热,收集产生的氧气。在该条件下测得氧气的体积与反应时间的关系如下图所示。已知:

①2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
②该条件下氧气的密度为1.40g·L-1;
③样品中的杂质不参与化学反应。
计算:
(1)完全反应后产生的氧气的质量为_______g。
(2)样品中氯酸钾的质量是多少_______?(写出计算过程,结果保留到小数点后两位)
【答案】0.70 1.79g
【解析】
根据生成的氧气的体积和密度求算对应的质量,进而结合对应的化学方程式求算氯酸钾的质量。
解:(1)生成氧气的质量为500mL×1L/1000mL×1.40gL-1=0.70g;
(2)设样品中氯酸钾的质量为m,
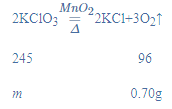
![]()
m≈1.79g;
答:(1)完全反应后产生的氧气的质量为 0.70g;
(2)样品中氯酸钾质量约为1.79g。

【题目】在一密闭容器中,物质X不完全燃烧时可以产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,正确的是
物质 | X | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. X中碳元素的质量分数为52.2% B. X中只含有C、H两种元素
C. 表中a的值为3.4 D. 无法确定X中是否含有氧元素
【题目】化学与生活、生产密切相关。
(1)我国首架大型客机C919中使用了大量的铝镁合金,铝制品在空气中不易被腐蚀,具有“自我保护”能力,其原因是_____(用化学方程式表示)。
(2)铝、铜、银是日常生活中接触到的三种金属。同学甲设计了如下三个实验来验证它们的金属活动性强弱:① 铝、硝酸银溶液;②铜、硫酸铝溶液;③铜、硝酸银溶液。同学乙认为这一方案中实验 ______(填“①”、“②”、“③”)可以不做,也能验证三个金属的活动性强弱。请写出实验③中的实验现象______。
(3)中国南海海底有大量的可燃冰(CH4·nH2O)。
① 可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N2、CO2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于________(选填“纯净物”或“混合物”)。
②甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | 一氧化碳 |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | 未测 |
根据表格中数据,请完成甲烷在一定量的氧气中燃烧的化学方程式 _______。
(4)某工厂利用废硫酸与废铁屑反应制取硫酸亚铁。现制得FeSO4 1.52 t,需要铁的质量至少是多少?(在答题卡上写出计算过程)_______