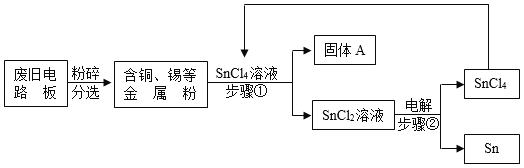
题目内容
【题目】如图是配制180g溶质质量分数为10%的NaCl溶液的实验操作示意图。
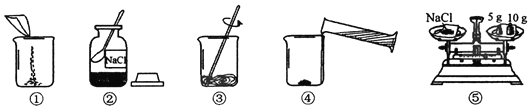
(1)正确的操作顺序是_____(填图中的数字序号)。
(2)请在图中画出即将向天平左侧托盘上加氯化钠固体进行称量时游码(用“![]() ”表示)的位置。
”表示)的位置。
![]()
(3)在称取氯化钠的过程中,观察到指针轻微的偏向分度盘的右侧,则接下来的操作应该是_____。
(4)实验中需要量取水的体积为_____mL,应选择规格为_____mL(选填“50”、“100”、“200”或“250”)的量筒来量取水。
(5)溶解时,用玻璃棒搅拌的作用是_____。
(6)下列操作会导致所配溶液的溶质质量分数偏大的是_____。
A.氯化钠固体不纯
B.配制溶液的烧杯事先用少量蒸馏水润洗
C.用量筒量取水时俯视读数
D.把配制好的溶液装入细口瓶时有少量液体洒出
【答案】②⑤①④③ ![]() 继续向左偏上添加氯化钠直至指针指向分度盘中间 162 200 加快氯化钠的溶解速率 C
继续向左偏上添加氯化钠直至指针指向分度盘中间 162 200 加快氯化钠的溶解速率 C
【解析】
(1)根据用固体溶质氯化钠配制溶液的步骤:计算-称量-溶解,先取氯化钠进行称取,倒入烧杯;然后量取水,倒入盛氯化钠的烧杯中;最后进行溶解;
(2)配制180g溶质质量分数为10%的NaCl溶液需要氯化钠的质量为:180g×10%=18g,砝码的质量为10g+5g=15g,游码的质量为3.0g,如图:![]() ;
;
(3)在称取氯化钠的过程中,观察到指针轻微的偏向分度盘的右侧,说明氯化钠的质量偏小,则接下来的操作应该是继续向左偏上添加氯化钠直至指针指向分度盘中间;
(4)需要量取的水的质量为:180g-18g=162g,体积为:162g÷1g/mL=162mL,需要选择规格为200mL的量筒来量取水;
(5)溶解时,用玻璃棒搅拌的作用是加快氯化钠的溶解速率;
(6)A、氯化钠固体不纯导致所配制溶液的溶质质量分数偏小,故错误;
B、配制溶液的烧杯事先用少量蒸馏水润洗造成水偏多,导致所配制溶液的溶质质量分数偏小,故错误;
C、用量筒量取水时俯视读数导致量取的水偏少,导致所配溶液的溶质质量分数偏大,故正确;
D、把配制好的溶液装入细口瓶时有少量液体洒出溶质质量分数是不变的,因为溶液是均一的,故错误。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】在一密闭容器中,物质X不完全燃烧时可以产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,正确的是
物质 | X | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. X中碳元素的质量分数为52.2% B. X中只含有C、H两种元素
C. 表中a的值为3.4 D. 无法确定X中是否含有氧元素
【题目】在点燃条件下,M和N反应生成X和Y。反应前后分子变化的微观示意图如下所示(其中“![]() ”代表氢原子,“
”代表氢原子,“![]() ”代表碳原子,“
”代表碳原子,“![]() ”代表氧原子)。下列叙述中,不正确的是
”代表氧原子)。下列叙述中,不正确的是
物质 | M | N | X | Y |
微观示意图 |
|
|
|
|
A.生成物均为氧化物
B.在该反应中,生成X和Y的质量比为9:22
C.M中碳、氢、氧三种元素的质量比为12:3:8
D.在该反应中,M和N两种物质的分子个数比为1:3