题目内容
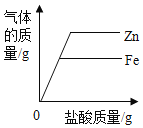
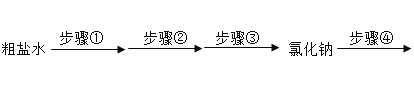
【题目】某合金的主要成分为 Zn、Fe 和 Cu。研究小组利用该合金制成的机械零件废弃物制取高纯度的 ZnO,其部分工艺流程如下图所示。请回答:
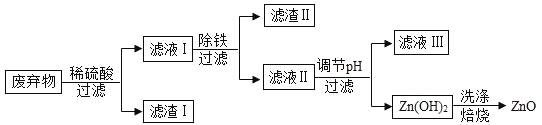
(1)实验前将废弃物处理成粉末的目的是:_________;
(2)滤渣Ⅰ中一定有_________;
(3)加酸溶解废弃物时,需要通风并远离火源,其原因是_________;
(4)焙烧 Zn(OH)2 发生分解反应的化学方程式为_________;
(5)研究小组利用上述的废弃物测定稀盐酸的溶质质量分数,他分四次向 182.5g 稀盐酸中加入含有杂质的废弃物,记录所加废弃物与产生氢气的质量如下表所示。
次数 | 1 | 2 | 3 | 4 |
废弃物质量/g | 5 | 5 | 5 | 5 |
氢气质量/g | 0.15 | 0.15 | 0.1 | 0 |
请帮小组计算稀盐酸的溶质质量分数________。
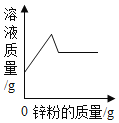
【答案】增大反应的接触面积,加快反应速率 铜(Cu) 产生氢气,容易引起爆炸 ![]() 8%
8%
【解析】
(1)废弃物处理成粉末,有利于增大反应的接触面积,加快反应速率,故答案为:增大反应的接触面积,加快反应速率。
(2)废弃物中有Zn、Fe 和 Cu,Zn和Fe 能和稀硫酸反应,所以滤渣Ⅰ一定有铜,故答案为铜(Cu)。
(3)加酸溶解废弃物时,Zn和Fe 能和稀硫酸反应会产生氢气,氢气是易燃易爆气体,所以需要通风并远离火源,故答案为:产生氢气,容易引起爆炸。
(4)焙烧 Zn(OH)2 产生氧化锌和水,反应的化学方程式为: ![]()
(5)由表可知,总的产生氢气的质量=0.15g+0.15g+0.1g=0.4g,氢气中氢元素的质量全部来源于盐酸中氢元素的质量,所以盐酸的质量如下
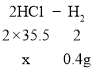
![]() ,
,
所以:稀盐酸的溶质质量分数=![]() ,故答案为8%。
,故答案为8%。

 阅读快车系列答案
阅读快车系列答案【题目】金属的用途与性质密切相关。
(1)如图所示赤铁矿的主要成分是________(填名称);

(2)家用电线常用铜制,但在高压远距离输电中,常用铝代替铜,请根据信息分析,其原因是_______________;
铜 | 铝 | |
密度/(gcm-3) | 8.92 | 2.70 |
地壳中含量(质量分数/%) | 0.007 | 7.73 |
导电性(以银的导电性为100做标准) |
| |
(3)在空气中,铝具有很好的抗腐蚀性,其原因是______;
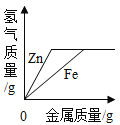
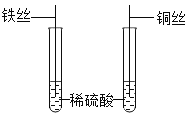
(4)为探究铁、铜的金属活动性,分别将铁丝、铜丝插入稀硫酸中(如图所示),说明铁比铜的金属活动性更强的实验现象是______,反应的化学方程式是______,后来,小贝选择两种药品,通过一步实验,也达到了实验目的,她选用的药品是 ____(写出一种药品组合即可);
(5)将一定质量的铁粉加入到Al(NO3)3、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是____(填字母)。
A 若滤液为蓝色,则滤渣中一定有银,可能有铜
B 若滤渣中含有银、铜、铁,则滤液中一定含有Al3+、Fe3+、NO3﹣
C 若滤液为浅绿色,则滤渣中一定含银、铜、铝
D 若滤渣中加稀盐酸无气泡产生,则滤液中一定有Al3+、Fe2+、Cu2+,可能有Ag+