题目内容
【题目】海水晒盐得到的粗盐中含有少量的CaCl2,Na2SO4、MgCl2杂质。将粗盐经过如下流程净化制得纯净氯化钠,再通过电解饱和食盐水得到相应的产物。请回答:
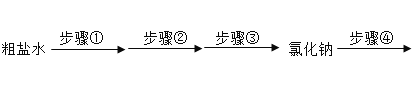
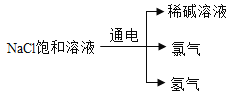
(1)根据所学知识推测,稀碱溶液中的溶质化学式为_____。
(2)在步骤①中除了可以按照BaCl2、NaOH、Na2CO3的顺序添加除杂试剂,其中利用氢氧化钠除去杂质的化学反应方程式为_____。上述试剂的添加顺序还可以选择的是_____(填字母)。
A Na2CO3→NaOH→BaCl2
B NaOH→BaCl2→Na2CO3
C Na2CO3→BaCl2→NaOH
(3)在步骤②中,滴加稀盐酸之前需要进行的操作是_____,滴加稀盐酸的作用是_____。
(4)将20℃时136g氯化钠的饱和溶液(20℃时,氯化钠溶解度为36g)稀释成溶质质量分数为15%的溶液,需要加入水的质量_____g,共主要操作顺序_____(填字母)。
A 计算→量取→混匀→装瓶贴签
B 计算→称量一量取→溶解→装瓶贴签
【答案】NaOH ![]() B 过滤 去除剩余的氢氧化钠和碳酸钠 104g A
B 过滤 去除剩余的氢氧化钠和碳酸钠 104g A
【解析】
(1)氯化钠饱和溶液电解后有氯气和氢气出现,说明电解过程中还要水的参与,而生成了稀碱溶液,因此可以推出为氢氧化钠的溶液,所以溶质为NaOH;
故答案为:NaOH。
(2)去除杂质离子,一般是生成沉淀物,氢氧化钠中氢氧根可与镁离子结合生成氢氧化镁沉淀,所以氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,因此该反应的化学方程式为![]() ;改变溶剂的添加顺序,保证杂质离子的顺利去除,同时避免引入新的杂质:
;改变溶剂的添加顺序,保证杂质离子的顺利去除,同时避免引入新的杂质:
A、先加入碳酸钠,可以去除氯化钙,剩余过量的碳酸钠,接着加入氢氧化钠,去除氯化镁,剩余过量的氢氧化钠,最后加入氯化钡,可以去除过量的碳酸钠和硫酸钠,但是还剩余了氯化钡、氢氧化钠,在步骤②加入盐酸,可以去除氢氧化钠,但是盐酸无法去除氯化钡,选项A不符合题意;
B、加入氢氧化钠,去除氯化镁,剩余了过量的氢氧化钠,接着加入氯化钡,去除硫酸钠,剩余了过量的氯化钡,最后加入碳酸钠,可以去除氯化钙,同时去除氯化钡,然后在步骤②中加入盐酸,去除氢氧化钠和碳酸钠,生成了氯化钠,选项B符合题意;
C、加入碳酸钠,去除氯化钙和氯化镁,剩余过量的碳酸钠,接着加入氯化钡,去除碳酸钠和硫酸钠,剩余过量的氯化钡,最后加入氢氧化钠,可以进一步去除氯化镁,同时剩余氢氧化钠,所以此时有剩余的氯化钡和氢氧化钠,在步骤②加入盐酸,可以去除氢氧化钠,氯化钡无法去除,选项C不符合题意;故选B;
(3)步骤①将杂质离子转化为了沉淀,所以加入盐酸前需要固液分离,因此需要过滤;因为加入氢氧化钠和碳酸钠为过量,所以加入稀盐酸后去除剩余的氢氧化钠和碳酸钠;
故答案为:过滤;去除剩余的氢氧化钠和碳酸钠。
(4)此温度下氯化钠溶解度为36g,所以136g饱和氯化钠溶液中则是有36g氯化钠和100g水,其中溶质质量为36g,溶液稀释前后溶质质量不变,设稀释后溶液质量为m,m×15%=36g,求得m=240g,加入水的质量=m-136g=240g-136g=104g;稀释溶液变为15%,通过计算加入所需水的质量,然后换算为水的体积,量取水的体积后,直接加入136g饱和氯化钠溶液,混合均匀,贴上标签,则为所需质量分数的溶液,因此顺序为计算→量取→混匀→装瓶贴签,故选A;
故答案为:A。

【题目】某合金的主要成分为 Zn、Fe 和 Cu。研究小组利用该合金制成的机械零件废弃物制取高纯度的 ZnO,其部分工艺流程如下图所示。请回答:
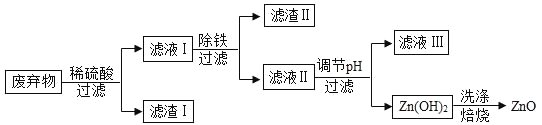
(1)实验前将废弃物处理成粉末的目的是:_________;
(2)滤渣Ⅰ中一定有_________;
(3)加酸溶解废弃物时,需要通风并远离火源,其原因是_________;
(4)焙烧 Zn(OH)2 发生分解反应的化学方程式为_________;
(5)研究小组利用上述的废弃物测定稀盐酸的溶质质量分数,他分四次向 182.5g 稀盐酸中加入含有杂质的废弃物,记录所加废弃物与产生氢气的质量如下表所示。
次数 | 1 | 2 | 3 | 4 |
废弃物质量/g | 5 | 5 | 5 | 5 |
氢气质量/g | 0.15 | 0.15 | 0.1 | 0 |
请帮小组计算稀盐酸的溶质质量分数________。