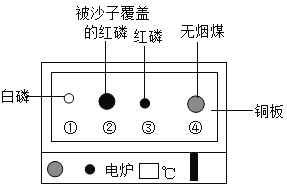
题目内容
【题目】下列图象能正确反映对应变化关系的是( )
A.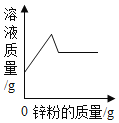 AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
B.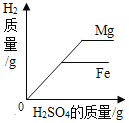 等质量镁粉、铁粉中分别加入足量等浓度的稀硫酸
等质量镁粉、铁粉中分别加入足量等浓度的稀硫酸
C.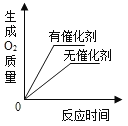 用两份等质量、等浓度的过氧化氢溶液分别制取氧气
用两份等质量、等浓度的过氧化氢溶液分别制取氧气
D.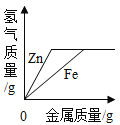 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
【答案】B
【解析】
A、AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量,锌先与硝酸银反应,参加反应的锌的质量小于生成银的质量,此过程中溶液的质量减小,图象中是先增大的,与实际不符,故A错误;
B、向等质量的镁粉和铁粉中分别加入足量且浓度相同的稀硫酸时,随着稀硫酸的加入,硫酸和镁、铁反应,当反应的硫酸质量相等时,产生的氢气质量也相等,因此起始阶段重合,因为向等质量的镁粉和铁粉中分别加入足量且浓度相同的稀硫酸,最终镁和稀硫酸反应生成的氢气多,该选项反映的关系合理,故B正确;
C、用等质量、等浓度的过氧化氢溶液水制取氧气,催化剂只能影响反应速率,不影响产生氧气的质量,选项图象与实际不符,故C错误;
D、金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等;生成等质量的氢气,消耗的铁的质量比锌少,选项图象与实际不符,故D错误。
故选B。

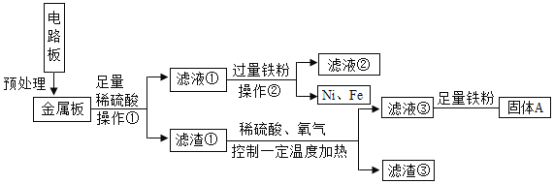
【题目】某合金的主要成分为 Zn、Fe 和 Cu。研究小组利用该合金制成的机械零件废弃物制取高纯度的 ZnO,其部分工艺流程如下图所示。请回答:
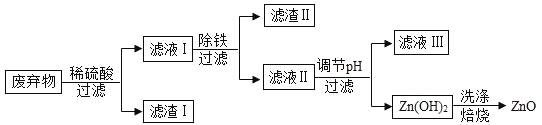
(1)实验前将废弃物处理成粉末的目的是:_________;
(2)滤渣Ⅰ中一定有_________;
(3)加酸溶解废弃物时,需要通风并远离火源,其原因是_________;
(4)焙烧 Zn(OH)2 发生分解反应的化学方程式为_________;
(5)研究小组利用上述的废弃物测定稀盐酸的溶质质量分数,他分四次向 182.5g 稀盐酸中加入含有杂质的废弃物,记录所加废弃物与产生氢气的质量如下表所示。
次数 | 1 | 2 | 3 | 4 |
废弃物质量/g | 5 | 5 | 5 | 5 |
氢气质量/g | 0.15 | 0.15 | 0.1 | 0 |
请帮小组计算稀盐酸的溶质质量分数________。