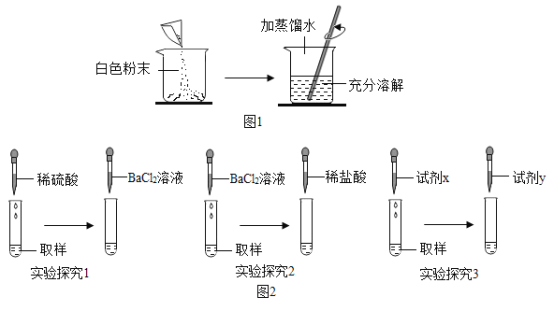
题目内容
【题目】根据图所示溶解度曲线判断,下列说法正确的是
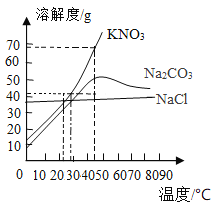
A. 28℃时,将40gKNO3溶于100g水得到饱和溶液
B. 将43℃的Na2CO3饱和溶液升高10℃,有晶体析出
C. 三种物质的饱和溶液由40℃降温至23℃,所得溶液中溶质质量:m(NaCl)=m(KNO3)>m(Na2CO3)
D. 除去KNO3中混有的Na2CO3,可在40 ℃配成饱和溶液,再降温结晶、过滤
【答案】B
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
A、28℃时,硝酸钾溶解度大于40g,将40gKNO3溶于100g水得到不饱和溶液,说法错误,不符合题意;
B、温度大于43℃,升高温度Na2CO3的溶解度减小,饱和溶液升高10℃,有晶体析出,说法正确,符合题意;
C、三种物质的饱和溶液质量不知道,无法比较,说法错误,不符合题意;
D、温度小于40℃, KNO3和Na2CO3的溶解度受温度影响相似,降温结晶不能除去KNO3中混有的Na2CO3,说法错误,不符合题意。
故选B。

【题目】空气是一种宝贵资源,如利用制得的氢气(H2)和空气中分离出的氮气(N2)合成氨气(NH3),下列是合成氨的工艺流程图:
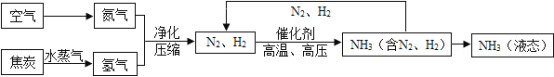
(1)根据上述流程写出氮气与氢气反应生成氨气的文字表达式_____。
(2)将沸点不同的气体分离开来,常采用液化分离法。如,控制温度在-183℃时,可将空气中氮气与氧气分离,这一过程是_____变化(填“物理”或“化学”)。根据下表中物质的沸点判断,要将产物 NH3与 N2、H2分离开来,温度应该控制在_____以下。
物质 | H2 | N2 | NH3 |
沸点/℃ | -252 | -195.8 | -33.35 |
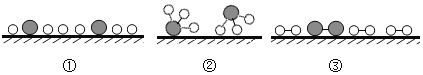
(3)用“![]() 、
、![]() 、
、![]() ”分别表示 N2、H2、NH3,用“
”分别表示 N2、H2、NH3,用“![]() ”表示催化剂,观察下列微观图,合成氨化学反应过程的微观顺序为_____(将下面三张图用序号排列)。
”表示催化剂,观察下列微观图,合成氨化学反应过程的微观顺序为_____(将下面三张图用序号排列)。
(4)上述流程中可以回收利用的物质是_____。