题目内容
【题目】在一次化学实验中,两组同学都完成了硫酸铜溶液与氢氧化钠溶液反应的实验,但观察到了不同的实验现象。
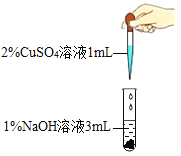
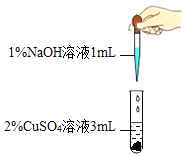
(进行实验一)
实验组 | 甲组 | 乙组 |
实验操作 |
|
|
实验现象 | 产生蓝色沉淀 | 产生蓝绿色沉淀 |
已知蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式_____。
(提出问题)乙组产生的蓝绿色沉淀的成分是什么呢?
(查阅资料)
(1)碱式硫酸铜是绿色晶体,在水中溶解度极小,能溶于稀酸溶液。
(2)碱式硫酸铜的组成不固定,一般可用Cu2(OH)2SO4表示。
(3)BaCl2溶液和含有SO42-的溶液反应能生成BaSO4(白色沉淀)。例如:BaCl2+H2SO4=BaSO4↓+2HCl
(猜想与假设)蓝绿色沉淀是碱式硫酸铜。
(进行实验二)
实验步骤 | 主要实验操作 | 现象及结论 |
① | 取乙组实验后的混合物过滤 | 得到蓝绿色沉淀 |
② | 取蓝绿色沉淀,用蒸馏水洗涤多次 | 无明显现象 |
③ | 向最后一次洗涤液中滴加BaCl2溶液 | 无沉淀产生 |
④ | 取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 | 沉淀全部溶解,得到蓝绿色溶液 |
⑤ | 取少量蓝绿色溶液于试管中,滴加… | 产生白色沉淀 |
实验结论:蓝绿色沉淀是碱式硫酸铜 | ||
(解释与结论)
(1)步骤③的实验目的是_______。
(2)步骤④中的稀盐酸能否用稀硫酸代替?________。
(3)步骤⑤滴加的试剂是________。
(反思与评价)
(4)甲组同学在本组实验的基础上进一步完成下列实验:
①过滤,取蓝色沉淀于试管中
②滴加________,沉淀颜色变为蓝绿色
③重复实验二中的步骤①~⑤
经实验验证,氢氧化铜也可以转化为碱式硫酸铜。此反应的化学方程式为________。
(5)乙组同学认为在自己组原有实验的基础上,继续滴加_______,可以将碱式硫酸铜转变为氢氧化铜。通过实验,也验证了他们的猜想。
(6)为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是_______。
【答案】CuSO4 + 2NaOH=Na2SO4 +Cu(OH)2↓ 检验蓝绿色沉淀是否洗涤干净 不能 BaCl2溶液 CuSO4溶液 Cu(OH)2+CuSO4=Cu2(OH)2SO4 NaOH溶液 氢氧化钠溶液要足量(或过量)
【解析】
进行实验一:硫酸铜溶液与氢氧化钠溶液反应,会生成氢氧化铜和硫酸钠,反应的方程式为:![]() 。故填:
。故填:![]() 。
。
解释与结论:
(1)生成的硫酸钠会与氯化钡反应产生白色沉淀硫酸钡,向最后一次洗涤液中加入氯化钡溶液,没有沉淀产生,说明过滤出的蓝绿色沉淀洗涤干净。故步骤③的实验目的是:检验蓝绿色沉淀是否洗涤干净。
(2)步骤④中的稀盐酸不能用稀硫酸代替,因为稀硫酸会与硫酸钡反应生成白色沉淀,对碱式硫酸铜中的硫酸根判断造成干扰。故填:不能。
(3)步骤⑤滴加的试剂是氯化钡溶液,目的是检验蓝绿色沉淀中含有硫酸根。故填:氯化钡溶液。
反思与评价:
(4)② 氢氧化铜沉淀是蓝色的,最后将氢氧化铜转化为碱式硫酸铜,所以需要向氢氧化铜中滴加硫酸铜,看到沉淀颜色变为蓝绿色。故填:CuSO4溶液;
③ 向氢氧化铜沉淀上滴加硫酸铜溶液后,重复实验二中的步骤①~⑤,经实验验证,氢氧化铜也可以转化为碱式硫酸铜。所以是氢氧化铜与硫酸铜反应生成碱式硫酸铜,此反应的化学方程式为:Cu(OH)2+CuSO4=Cu2(OH)2SO4。故填:Cu(OH)2+CuSO4=Cu2(OH)2SO4。
(5)由以上分析和探究得出乙组最终得到的蓝绿色沉淀是碱式硫酸铜,由(4)中分析得出,硫酸铜与氢氧化钠反应,硫酸铜过量时会生成碱式硫酸铜,以此类推,如果氢氧化钠过量就会生成氢氧化铜,所以乙组同学认为在自己组原有实验的基础上,继续滴加氢氧化钠溶液,可以将碱式硫酸铜转变为氢氧化铜。通过实验,也验证了他们的猜想。故填:NaOH溶液。
(6)由(5)中分析,硫酸铜与氢氧化钠反应,硫酸铜过量时会生成碱式硫酸铜,氢氧化钠过量就会生成氢氧化铜,为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是氢氧化钠溶液要过量。故填:氢氧化钠溶液要足量(或过量)。

【题目】九年级(三)班化学兴趣小组为测定大理石中碳酸钙的含量,如下图所示:

将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间 / 分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/C | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x= 。
(2)计算大理石样品中碳酸钙的质量分数。
(3)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线;

(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HCl气体,你认为对测量结果有没有影响? (填“有”或“没有”)