题目内容
【题目】下列图象能正确反映其对应关系的是( )
A.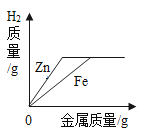 向等质量、等浓度的稀硫酸中分别加入过量的Zn和Fe
向等质量、等浓度的稀硫酸中分别加入过量的Zn和Fe
B.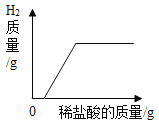 向一枚表面生锈的铁钉中逐滴加入稀盐酸
向一枚表面生锈的铁钉中逐滴加入稀盐酸
C.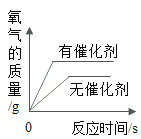 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气
用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气
D.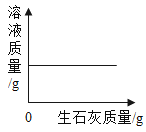 一定温度时,向一定量的饱和石灰水中加入生石灰
一定温度时,向一定量的饱和石灰水中加入生石灰
【答案】B
【解析】
A、金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等;根据金属不足时,生成氢气的质量与金属(+2价金属)的相对原子质量成反比,生成等质量的氢气,消耗的锌多,故选项图象错误。
B、向表面生锈的铁钉中滴加过量的稀盐酸,稀盐酸先和氧化铁反应生成氯化铁和水,后和铁反应生成氯化亚铁和氢气,故选项图象正确。
C、用等质量、等浓度的过氧化氢制取氧气,催化剂只能影响反应速率,不影响产生氧气的质量,故选项图象错误。
D、由于氧化钙能与水发生反应生成氢氧化钙,氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,所以溶液的质量减少,故选项图象错误。
故选:B。

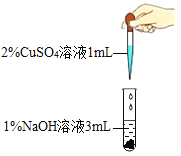
【题目】在一次化学实验中,两组同学都完成了硫酸铜溶液与氢氧化钠溶液反应的实验,但观察到了不同的实验现象。
(进行实验一)
实验组 | 甲组 | 乙组 |
实验操作 |
|
|
实验现象 | 产生蓝色沉淀 | 产生蓝绿色沉淀 |
已知蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式_____。
(提出问题)乙组产生的蓝绿色沉淀的成分是什么呢?
(查阅资料)
(1)碱式硫酸铜是绿色晶体,在水中溶解度极小,能溶于稀酸溶液。
(2)碱式硫酸铜的组成不固定,一般可用Cu2(OH)2SO4表示。
(3)BaCl2溶液和含有SO42-的溶液反应能生成BaSO4(白色沉淀)。例如:BaCl2+H2SO4=BaSO4↓+2HCl
(猜想与假设)蓝绿色沉淀是碱式硫酸铜。
(进行实验二)
实验步骤 | 主要实验操作 | 现象及结论 |
① | 取乙组实验后的混合物过滤 | 得到蓝绿色沉淀 |
② | 取蓝绿色沉淀,用蒸馏水洗涤多次 | 无明显现象 |
③ | 向最后一次洗涤液中滴加BaCl2溶液 | 无沉淀产生 |
④ | 取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 | 沉淀全部溶解,得到蓝绿色溶液 |
⑤ | 取少量蓝绿色溶液于试管中,滴加… | 产生白色沉淀 |
实验结论:蓝绿色沉淀是碱式硫酸铜 | ||
(解释与结论)
(1)步骤③的实验目的是_______。
(2)步骤④中的稀盐酸能否用稀硫酸代替?________。
(3)步骤⑤滴加的试剂是________。
(反思与评价)
(4)甲组同学在本组实验的基础上进一步完成下列实验:
①过滤,取蓝色沉淀于试管中
②滴加________,沉淀颜色变为蓝绿色
③重复实验二中的步骤①~⑤
经实验验证,氢氧化铜也可以转化为碱式硫酸铜。此反应的化学方程式为________。
(5)乙组同学认为在自己组原有实验的基础上,继续滴加_______,可以将碱式硫酸铜转变为氢氧化铜。通过实验,也验证了他们的猜想。
(6)为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是_______。